Содержание
электрохимическая коррозия, химическая коррозия, катодная коррозия, атмосферная коррозия, газовая коррозия и др.
Коррозионные процессы классифицируют по механизму взаимодействия металлов с внешней средой; по виду коррозионной среды и условиям протекания процесса; по характеру коррозионных разрушений; по видам дополнительных воздействий, которым подвергается металл одновременно с действием коррозионной среды.
По механизму процесса различают химическую и электрохимическую коррозию металлов.
Химическая коррозия — это процесс взаимодействия металла с коррозионной средой, при котором окисление металла и восстановление окислительного компонента среды протекают единовременно в одном акте. Продукты взаимодействия пространственно не разделены.
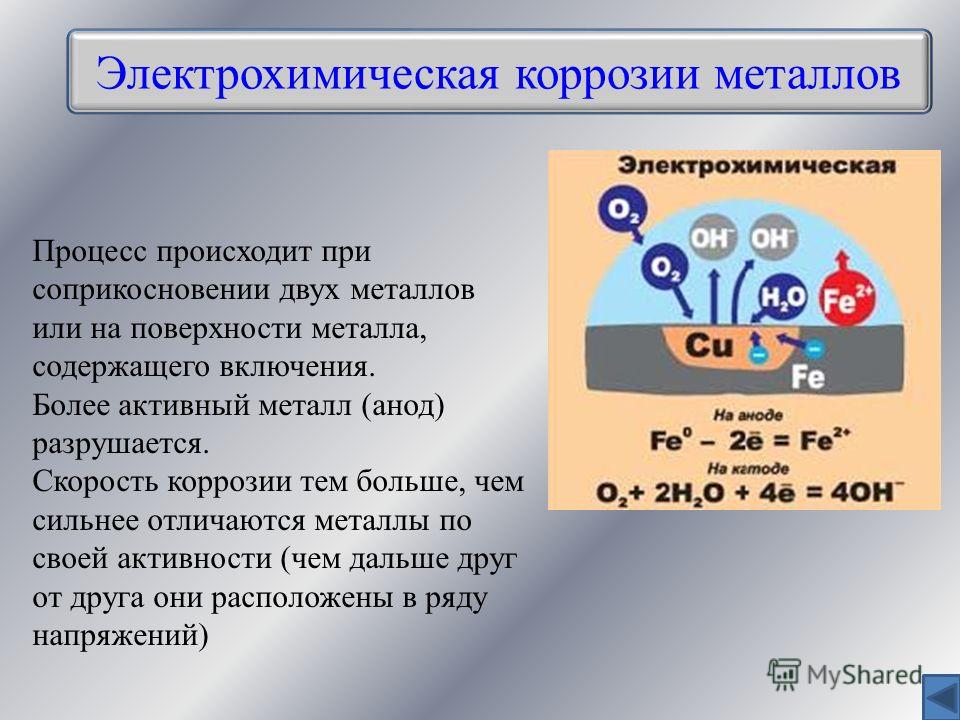
Электрохимическая коррозия — это процесс взаимодействия металла с коррозионной средой (раствором электролита), при котором ионизация атомов металла и восстановление окислительного компонента коррозионной среды протекают не в одном акте и их скорости зависят от электродного потенциала.
По виду коррозионной среды и условиям протекания различают несколько видов коррозии.
Газовая коррозия — это химическая коррозия металлов в газовой среде при минимальном содержании влаги (как правило не более 0,1%) или при высоких температурах. В химической и нефтехимической промышленности такой вид коррозии встречается часто. Например, при получении серной кислоты на стадии окисления диоксида серы, при синтезе аммиака, получении азотной кислоты и хлористого водорода, в процессах синтеза органических спиртов, крекинга нефти и т.д.
Атмосферная коррозия — это коррозия металлов в атмосфере воздуха или любого влажного газа.
Подземная коррозия — это коррозия металлов в почвах и грунтах.
Биокоррозия — это коррозия, протекающая под влиянием жизнедеятельности микроорганизмов.
Контактная коррозия — это вид коррозии, вызванный контактом металлов, имеющих разные стационарные потенциалы в данном электролите.
Радиационная коррозия — это коррозия, обусловленная действием радиоактивного излучения.
Коррозия внешним током и коррозия блуждающим током. В первом случае — это коррозия металла, возникающая под воздействием тока от внешнего источника. Во втором случае — под воздействием блуждающего тока.
Коррозия под напряжением — коррозия, вызванная одновременным воздействием коррозионной среды и механических напряжений. Если это растягивающие напряжения, то может произойти растрескивание металла. Это очень опасный вид коррозии, особенно для конструкций, испытывающих механические нагрузки (оси, рессоры, автоклавы, паровые котлы, турбины и т.д.). Если металлические изделия подвергаются циклическим растягивающим напряжениям, то можно вызвать коррозионную усталость. Происходит понижение предела усталости металла. Такому виду коррозии подвержены рессоры автомобилей, канаты, валки прокатных станов.
Коррозионная кавитация — разрушение металла, обусловленное одновременным коррозионным и ударным воздействием внешней среды.
Фреттинг-коррозия — это коррозия, вызванная одновременно вибрацией и воздействием коррозионной среды. Устранить коррозию при трении или вибрации возможно правильным выбором конструкционного материала, снижением коэффициента трения, применением покрытий и т.д.
Устранить коррозию при трении или вибрации возможно правильным выбором конструкционного материала, снижением коэффициента трения, применением покрытий и т.д.
Коррозия называется сплошной, если она охватывает всю поверхность металла. Сплошная коррозия может быть равномерной, если процесс протекает с одинаковой скоростью по всей поверхности металла, и неравномерной когда скорость процесса неодинакова на различных участках поверхности. Равномерная коррозия наблюдается, например, при коррозии железных труб на воздухе.
При избирательной коррозии разрушается одна структурная составляющая или один компонент сплава. В качестве примеров можно привести графитизацию чугуна или обесцинкование латуней.
Местная (локальная) коррозия охватывает отдельные участки поверхности металла. Местная коррозия может быть выражена в виде отдельных пятен, не сильно углубленных в толщу металла; язв — разрушений, имеющих вид раковины, сильно углубленной в толщу металла, или точек (питтингов), глубоко проникающих в металл.
Первый вид наблюдается, например, при коррозии латуни в морской воде. Язвенная коррозия отмечена у сталей в грунте, а питтинговая — у аустенитной хромоникелевой стали в морской воде.
Подповерхностная коррозия начинается на поверхности, но затем распространяется в глубине металла. Продукты коррозии оказываются сосредоточенными в полостях металла. Этот вид коррозии вызывает вспучивание и расслоение металлических изделий.
Межкристаллитная коррозия характеризуется разрушением металла по границам зерен. Она особенно опасна тем, что внешний вид металла не меняется, но он быстро теряет прочность и пластичность и легко разрушается. Связано это с образованием между зернами рыхлых малопрочных продуктов коррозии. Этому виду разрушений особенно подвержены хромистые и хромоникелевые стали, никелевые и алюминиевые сплавы.
Щелевая коррозия вызывает разрушение металла под прокладками, в зазорах, резьбовых креплениях и т.д.
Урок 9. коррозия металлов и её предупреждение — Химия — 11 класс
Химия, 11 класс
Урок № 9. Коррозия металлов и её предупреждение
Коррозия металлов и её предупреждение
Перечень вопросов, рассматриваемых в теме: урок посвящён изучению видов коррозии, особенностям химической и электрохимической коррозии, методам защиты металлических изделий от коррозионного разрушения.
Глоссарий
Анодное покрытие – способ защиты металлического изделия от коррозии, когда защищаемый металл покрывается металлическим покрытием из более активного металла.
Газовая коррозия – разрушение металла в среде агрессивных газов (кислорода, оксида серы, хлороводорода) обычно при высоких температурах.
Гальванокоррозия – вид электрохимической коррозии, при которой два контактирующих металла в среде электролита образуют коррозионный гальванический элемент с возникновением электрического тока между металлами.
Жидкостная коррозия – разрушение металла в жидкостях, не проводящих электрический ток (органические растворители, нефтепродукты).
Ингибиторы – вещества, вводимые в коррозионную среду, в результате чего снижается её окисляющая способность.
Катодная защита – способ защиты металла от коррозии, когда защищаемое металлическое изделие подсоединяется к отрицательному полюсу внешнего источника электрического тока.
Катодное покрытие – способ защиты металла от коррозии, когда металлическое изделие покрывается тонким слоем из менее активного металла.
Коррозия – разрушение металла в результате окислительно-восстановительных реакций между металлом и окружающей средой
Осушение – удаление из окружающей среды влаги для предотвращения возникновения коррозии.
Протекторная защита – способ защиты металла от коррозии, когда к защищаемому металлическому изделию присоединяют кусок другого, более активного металла.
Химическая коррозия – разрушение металла в среде, не проводящей электрический ток.
Электрокоррозия – вид электрохимической коррозии, возникающей в среде электролита под действием внешнего электрического поля.
Электрохимическая коррозия – разрушение металла в среде электролита при контакте двух металлов с образованием коррозионного элемента и возникновением электрического тока.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Дополнительная литература:
1. Рябов, М.А. Сборник задач, упражнений и тестов по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс: учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
- Единое окно доступа к информационным ресурсам [Электронный ресурс]. М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
Коррозия и её виды
Коррозия металлов – процесс разрушения металлического изделия в результате окислительно-восстановительной реакции металла с окружающей средой. В зависимости от механизма различают два вида коррозии: химическую и электрохимическую. Химическая коррозия происходит в среде, не проводящей электрический ток. К этому виду коррозии относится газовая коррозия, в результате которой металл разрушается под действием агрессивных газов: кислорода, оксида серы, хлороводорода. Газовая коррозия обычно происходит при высоких температурах. Другой вид химической коррозии – жидкостная коррозия, которая возникает в агрессивных жидкостях, не проводящих электрический ток, например, в органических растворителях или нефтепродуктах.
В зависимости от механизма различают два вида коррозии: химическую и электрохимическую. Химическая коррозия происходит в среде, не проводящей электрический ток. К этому виду коррозии относится газовая коррозия, в результате которой металл разрушается под действием агрессивных газов: кислорода, оксида серы, хлороводорода. Газовая коррозия обычно происходит при высоких температурах. Другой вид химической коррозии – жидкостная коррозия, которая возникает в агрессивных жидкостях, не проводящих электрический ток, например, в органических растворителях или нефтепродуктах.
Электрохимическая коррозия происходит в среде электролитов, которые хорошо проводят электрический ток. Различают два вида электрохимической коррозии: гальванокоррозия и электрокоррозия. Гальванокоррозия возникает в месте контакта двух металлов, наличия в металле примесей, разной температуры на соседних участках металлов, разной концентрации электролитов в среде, контактирующей с металлом и в случае разной концентрации кислорода на соседних участках металла. Например, в чугуне примеси углерода и карбида железа играют роль катода, на котором происходит восстановление молекулярного кислорода в присутствии паров воды: 2Н2О + О2 + 4е → 4ОН-, а железо становится анодом и окисляется.
Например, в чугуне примеси углерода и карбида железа играют роль катода, на котором происходит восстановление молекулярного кислорода в присутствии паров воды: 2Н2О + О2 + 4е → 4ОН-, а железо становится анодом и окисляется.
Fe0 – 2e → Fe2+. В результате среда становится щелочной, образуется сначала «белая» ржавчина Fe(ОН)2: Fe2+ + 2OH— → Fe(ОН)2↓, которая окисляется кислородом воздуха во влажной среде до трёхвалентного гидроксида железа.
4Fe(ОН)2↓ + 2Н2О + О2 → 4Fe(ОН)3↓, Fe(OH)3 + nh3O → Fe2O3·xh3O (ржавчина).
Если в атмосфере присутствует большое количество кислых газов (СО2, SO2, NO2), то при растворении их в воде образуются кислоты. В кислой среде коррозия идет ещё интенсивнее. В присутствии кислорода на катоде образуется вода, а в бескислородной среде выделяется водород.
На аноде: Fe0 – 2е → Fe2+;
На катоде: О2 + 4Н+ + 4е → 2Н2О
или в бескислородной среде: 2Н+ + 2е → Н20↑.
Ионы железа образуют соли с кислотными остатками образовавшихся при растворении газов кислот. В дальнейшем под действием кислорода воздуха, соли двухвалентного железа окисляются до солей трёхвалентного железа.
Электрокоррозия возникает под действием на металл электрического тока от внешнего источника постоянного тока. Часто она происходит под действием блуждающих токов от рельсов электротранспорта, от плохо изолированных опор линий электропередач. Участок, на который попадает ток от внешнего источника, заряжается отрицательно и становится катодом. На нём происходит восстановление элементов среды. А соседний участок становится анодом, на нём металл окисляется.
Факторы, увеличивающие скорость коррозии
Возникновение коррозионного гальванического элемента увеличивает скорость коррозии. При контакте двух металлов более активный металл отдает электроны менее активному. Возникает электрический ток. Активный металл растворяется и в результате реакции со средой, и за счет передачи электронов менее активному металлу. Принятые электроны менее активный металл отдает в окружающую среду, таким образом, окисление активного металла и восстановление компонентов окружающей среды происходит быстрее. Скорость коррозии зависит от количества кислорода, который контактирует с металлом. Железный гвоздь, погруженный в воду на половину своей длины, разрушается быстрее всего, так как доступу кислорода ничего не препятствует. Гвоздь, полностью погруженный в воду, разрушается медленнее, так как количество кислорода, участвующего в реакции, ограничивается скоростью растворения кислорода в воде. В пробирке, где сверху воды налили масло, коррозия идет медленнее всего, так как масло препятствует поступлению кислорода в воду.
Принятые электроны менее активный металл отдает в окружающую среду, таким образом, окисление активного металла и восстановление компонентов окружающей среды происходит быстрее. Скорость коррозии зависит от количества кислорода, который контактирует с металлом. Железный гвоздь, погруженный в воду на половину своей длины, разрушается быстрее всего, так как доступу кислорода ничего не препятствует. Гвоздь, полностью погруженный в воду, разрушается медленнее, так как количество кислорода, участвующего в реакции, ограничивается скоростью растворения кислорода в воде. В пробирке, где сверху воды налили масло, коррозия идет медленнее всего, так как масло препятствует поступлению кислорода в воду.
Методы защиты металлов от коррозии
Одним из распространённых методов защиты металлов от коррозии является нанесение защитных покрытий. Покрытия бывают металлическими и неметаллическими. Если металлическое изделие покрыто слоем более активного металла, покрытие называют анодным. Если покрытие изготовлено из менее активного металла, оно называется катодным. Неметаллические покрытия – это различные эмали, лаки, краски, резиновые, битумные и полимерные покрытия. По отношению к железу анодными покрытиями будут цинковые, хромовые, алюминиевые покрытия. Эти покрытия защищают металл даже в случае появления царапин или трещин. Так как покрытие изготовлено из более активного металла, оно является анодом по отношению к защищаемому металлу и будет разрушаться. Защищаемое металлическое изделие разрушаться не будет. Катодные покрытия обычно делают из малоактивных металлов. Это никель, олово, свинец, медь, серебро, золото. Из-за низкой активности такие металлы слабо подвергаются воздействию коррозии, но в случае нарушения покрытия, возникнет коррозионный элемент, в котором анодом станет защищаемое металлическое изделие. Оно начнет разрушаться. Защитные оксидные покрытия на поверхности металла можно создать путем химической обработки концентрированной азотной кислотой (пассивация алюминия, хрома), концентрированным раствором щелочи и горячего масла (воронение), фосфорной кислотой и её кислыми солями (фосфатирование).
Неметаллические покрытия – это различные эмали, лаки, краски, резиновые, битумные и полимерные покрытия. По отношению к железу анодными покрытиями будут цинковые, хромовые, алюминиевые покрытия. Эти покрытия защищают металл даже в случае появления царапин или трещин. Так как покрытие изготовлено из более активного металла, оно является анодом по отношению к защищаемому металлу и будет разрушаться. Защищаемое металлическое изделие разрушаться не будет. Катодные покрытия обычно делают из малоактивных металлов. Это никель, олово, свинец, медь, серебро, золото. Из-за низкой активности такие металлы слабо подвергаются воздействию коррозии, но в случае нарушения покрытия, возникнет коррозионный элемент, в котором анодом станет защищаемое металлическое изделие. Оно начнет разрушаться. Защитные оксидные покрытия на поверхности металла можно создать путем химической обработки концентрированной азотной кислотой (пассивация алюминия, хрома), концентрированным раствором щелочи и горячего масла (воронение), фосфорной кислотой и её кислыми солями (фосфатирование).
Эффективным, но дорогим методом защиты металлов от коррозии является введение в сплав антикоррозионных легирующих добавок: хрома, никеля, молибдена, титана. Для повышения стойкости к коррозии в кислой среде в сплав добавляют кремний.
К методам электрохимической защиты относятся протекторная и катодная защита. Протекторная защита предусматривает закрепление на защищаемом изделии пластин из активного металла: цинка, алюминия, магния. Попадая в агрессивную среду, протектор становится анодом, начинает разрушаться, а металлическое изделие, являясь катодом, не разрушается до полного разрушения протектора. Катодная защита производится путём подсоединения защищаемого металлического изделия к отрицательному полюсу внешнего источника постоянного электрического тока. В результате защищаемый металл приобретает отрицательный заряд и становится катодом. В качестве анода используют вспомогательный кусок металла (железный лом, старый рельс), который заземляют.
Важным направлением предотвращения коррозии металлов является снижение агрессивности окружающей среды. Для этого проводят осушение почвы, воздуха. В жидкие среды добавляют ингибиторы – вещества, реагирующие с окислительными компонентами среды и снижающие скорость коррозии. Для борьбы с блуждающими токами проводят надёжную изоляцию токопроводящих конструкций, организацию бесстыкового пути.
Для этого проводят осушение почвы, воздуха. В жидкие среды добавляют ингибиторы – вещества, реагирующие с окислительными компонентами среды и снижающие скорость коррозии. Для борьбы с блуждающими токами проводят надёжную изоляцию токопроводящих конструкций, организацию бесстыкового пути.
Предотвращение потерь металла от коррозии позволит не только сберечь тонны металла, но и предотвратить аварии на производстве и транспорте, сберечь человеческие жизни.
ПРИМЕРЫ И РАЗБОР РЕШЕНИЙ ЗАДАЧ ТРЕНИРОВОЧНОГО МОДУЛЯ
1. Расчёт массы металла, предохраняемого от разрушения за счёт нанесения защитных покрытий
Условие задачи: В результате атмосферной коррозии толщина стального изделия уменьшается на 0,12 мм/год. Потерю какой массы стального изделия плотностью 7750 кг/м3 и площадью 10 м2 можно предотвратить путем нанесения лакокрасочного покрытия, которое сохраняет свои защитные свойства в течение 4 лет? Ответ запишите в виде целого числа в килограммах.
Шаг первый: необходимо перевести скорость коррозии из мм/год в м/год.
Для этого скорость коррозии умножим на 10-3:
0,12·10-3 = 1,2·10-4 (м/год).
Шаг второй: Найдём объём слоя металла, который может быть разрушен коррозией за 1 год. Для этого толщину слоя разрушенного в течение года металла умножим на площадь стального изделия:
1,2·10-4·10 = 1,2·10-3 (м3/год).
Шаг третий: Найдём массу вычисленного объёма металла.
Для этого объём металла умножим на его плотность:
1,2·10-3·7750 = 9,3 (кг/год).
Шаг четвёртый: Найдём массу металла, которая могла бы разрушиться за 4 года. Для этого массу сохранённого за год металла умножим за 4 года:
9,3·4 = 37,2 (кг). Округляем до целого числа, получаем 37 (кг).
Ответ: 37
2. Расчёт массы металла, разрушенного в результате коррозии
Условие задачи: Через железную решётку, предохраняющую от попадания в канализацию крупного мусора, проходит 20 м3 воды в сутки. Содержание кислорода в воде 1 % от объёма воды. Какая масса железа окислится за 6 месяцев использования решётки, если на окисление металла расходуется 60% содержащегося в воде кислорода? Ответ записать в килограммах в виде целого числа.
Содержание кислорода в воде 1 % от объёма воды. Какая масса железа окислится за 6 месяцев использования решётки, если на окисление металла расходуется 60% содержащегося в воде кислорода? Ответ записать в килограммах в виде целого числа.
Шаг первый: найдём объём кислорода, который содержится в 20 м3 воды.
Для этого разделим 20 м3 на 100:
20 : 100 = 0,2 (м3/сутки) = 200 (л/сутки)
Шаг второй: Найдём объём кислорода, который проходит в воде через решётку в течение 6 месяцев.
Для этого объём кислорода, проходящий через решетку в сутки, умножим на 30 дней и на 6 месяцев:
200·30·6 = 36000 (л).
Шаг третий: Найдём объём кислорода, который расходуется на окисление железа. Для этого умножим найденный объём кислорода на 60 и разделим на 100:
(36000·60) : 100 = 21600 (л).
Шаг четвёртый: Запишем уравнение реакции взаимодействия железа с кислородом в нейтральной среде:
2Fe + O2 + 2H2O → 2Fe(OH)2.
Шаг пятый: Найдём массу железа, окисленного 21600 л кислорода.
Для этого составим пропорцию с учётом того, что масса 1 моль железа равна 56 г/моль, а 1 моль газа в нормальных условиях занимает 22,4 л.
2·56 г железа реагирует с 22,4 л кислорода;
х г железа реагирует с 21600 л кислорода.
х = (2·56·21600) : 22,4 = 108000 (г) = 108 кг.
Ответ: 108.
Учебный процесс
Общественная работа
Воспоминания об Илье Николаевиче Андрееве
|
ХИМИЧЕСКАЯ
|
| Рис.
7. Слоистое строение окалины, образующейся на железе при его окислении на воздухе при повышенной температуре. |
При
коррозии металлов в таких условиях
образуется окалина. На железе, стали,
чугунах окалина имеет сложное строение:
часто она состоит из трех слоев (рис. 7) с
7) с
разной концентрацией кислорода и степенью
окисления железа (рис. 8).
Слоистость
окалины наблюдается вследствие убывания
концентрации кислорода в пленке окалины
по мере приближения к металлу, так как
каждый из слоев представляет барьер на
пути диффузии кислорода к металлу. При
окислении сплавов состав окалины может
быть переменным)
При
кислородной коррозии стали происходит ее
обезуглероживание. Углерод в стали
находится в виде цементита Fе3C,
возникновение которого в процессе
термообработки обеспечивает ее высокую
прочность. Под действием кислорода
цементит окисляется, и сталь теряет в
поверхностных слоях свои прочностные
свойства. В чугуне углерод содержится не
только в виде цементита, но и в форме
пластинчатого графита, который
располагается по границам зерен металла,
где и происходит наиболее интенсивная
диффузия кислорода. Окислению
Окислению
подвергаются участки металла,
расположенные на границе зерен. Поскольку
продукты окисления имеют больший объем,
чем металл, из которого они образовались,
то происходит увеличение объема металла
при коррозии (так называемый «рост
чугуна»).
| Рис.9.
Распределение никеля, хрома и магния по сечению окалины на сплаве Ni-10% Cr-0,5% Mg после окисления в течение 10 час. |
Кислородсодержащие
газы вызывают снижение поверхностной
прочности металлов, вследствие чего они
оказываются подверженными более
интенсивному износу. Причиной этого
явления также оказывается удаление
цементита из поверхностных слоев металла.
Износ топочного оборудования при высоких
температурах происходит благодаря его
контакту с газом, омывающим трубы при
большой скорости. Вместе с газом
перемещаются и твердые частицы топлива и
шлака, имеющие абразивные свойства. Кроме
того, в топочных газах обычно содержится
окись углерода, которая при температурах
250–400°С способна реагировать с
металлами, образуя летучие продукты (карбонилы),
уносящиеся вместе с топочными газами. Этот
вид коррозии называется карбонильной
коррозией металла.
В
серусодержaщих
высокотемпературных газах на поверхности
железа, стали, чугунов и других металлов
образуется сульфидная или смешанная
окалина, которая обладает свойствами,
близкими к свойствам кислородной окалины.
Она является препятствием для диффузии
реагентов друг к другу и проявляет
защитное действие. Некоторые виды окалины,
Некоторые виды окалины,
например сульфидная окалина никеля,
образуют с никелем легкоплавкие вещества,
В этом случае возможен переход химической
газовой коррозии в высокотемпературную
электрохимическую.
Водородная
коррозия вызывает изменение механических
свойств металлов (повышается хрупкость
стали, происходит ее расслоение, «пузырение»).
Хрупкое разрушение при водородной
коррозии происходит в тех случаях, когда
сталь имеет высокие прочностные
показатели (высокоуглеродистая сталь).
Мягкие пластичные стали могут
подвергаться расслоению, пузырению.
Причиной водородной коррозии является
диффузия водорода в сталь и другие
материалы, происходящая при высоких
температурах. Это может иметь место,
например, в аппаратуре для синтеза аммиака.
Проникающий
в металл водород в таких случаях
взаимодействует с цементом, образуя
газообразные соединения, например метан СН4,
который в стали не растворяется, а
собирается в отдельных пустотах, трещинах,
дефектах металла, вызывая внутренние
напряжения, из-за которых приходится
снижать рабочие нагрузки на детали. В
В
результате в мягких сталях возникают
пузыри, и металл расслаивается, а
высокопрочные стали при относительно
небольших механических нагрузках
подвергаются хрупкому разрушению.
Медь,
а также некоторые ее сплавы могут быть
склонны к водородной коррозии в тех случаях,
когда недостаточно глубоко проведено их
раскисление в процессе металлургического
производства, то есть, когда в металле
сохранился кислород, например, в виде
закиси меди Cu2O
. Этот
оксид образует отдельную фазу в металле, а
проникающий в металл водород, химически
взаимодействуя с ним, восстанавливает его.
При этом возникает водяной пар, который при
высокой температуре может быть причиной
возникновения хрупкости меди.
Некоторые
металлы, например титан, способны поглощать
(абсорбировать) большие количества
кислорода при высокой температуре. Если
такой металл оказывается
затем в контакте с водородом, то также
может наблюдаться водородная коррозия,
снижающая его прочность.
При
сжигании топлив, содержащих соединения
ванадия, в мазутных топках парогенераторов
возникает ванадиевая коррозия.
Особенностью ее является то, что она может
проходить как электрохимическая благодаря
образованию расплава на поверхности
металла, возникающего при взаимодействии
оксида ванадия с железной окалиной.
Галогенидная
коррозия представляет собой процесс
коррозии металлов в хлористом водороде,
хлоре, фторе, броме, йоде с образованием
галогенидов. Обычно при низких
температурах большинство металлов слабо
взаимодействует с этими веществами, но при
температуре 200–300°С
происходит самоускорение этих реакций и
некоторые металлы буквально сгорают в этих
условиях с большой скоростью.
Чтобы
определить, возможно ли окисление металла,
т. е. может ли начаться коррозионный процесс,
используют несколько методов. Один из них,
Один из них,
наиболее простой, следующий. В
кислородсодержащих газах сопоставляют
давление кислорода в газовой смеси (коррозионной
среде) и давление распада (диссоциации)
окисла металла. Эту величину находят в
справочных таблицах. Например, требуется
определить, возможно ли окисление палладия
на воздухе и в кислороде при 800°С.
Сопоставляя табличную величину давления
диссоциации оксида палладия, равную 0,61, с
давлением кислорода в воздухе, равным 0,21,
можно сделать заключение, что в воздухе
окисления палладия быть не может, поскольку
давление кислорода меньше табличной
величины. Но в чистом кислороде палладий
будет окисляться, так как давление
кислорода равно 1. Обратимся еще к одному
примеру. Попытаемся определить, возможна ли
сульфидная коррозия серебра при 200°С в
смеси водорода и сероводорода. Поскольку
коррозия серебра происходит в результате
взаимодействия серебра с сероводородом с
образованием водорода, сульфидная коррозия
может происходить в том случае, если
отношения давлений сероводорода и водорода
больше или равны 0,2. Это означает, что при
Это означает, что при
всех других соотношениях давлений этих
газов можно защитить металл от сульфидной
коррозии, выбрав соответствующий состав
газовой смеси. Такой прием используют,
применяя так называемые «защитные
атмосферы» при нагреве металла в процессе
его термической обработки; в печи,
используемой для нагрева металла, создают
газовую смесь определенного состава,
который подбирают так, чтобы исключалось
окисление металла.
В
результате взаимодействия металла и
коррозионной среды образуются
газообразные, жидкие или твердые продукты.
От их свойств и агрегатного состояния
зависит, в какой степени образующиеся
продукты влияют на скорость взаимодействия
металла с коррозионной средой. Так,
газообразные продукты удаляются с
поверхности, не препятствуя взаимодействию
окислителя с металлом. Твердые продукты
могут образовать пленку на поверхности
металла, и развитие взаимодействия металла
с окислителем вследствие этого может быть
затруднено. Жидкая пленка продуктов также
Жидкая пленка продуктов также
может затруднять коррозионное
взаимодействие, но в меньшей степени, чем
твердая. Если жидкая пленка
электропроводна, коррозионный процесс из
химического может превратиться в
электрохимический. Это важно отметить, так
как скорость электрохимического процесса
при высоких температурах может быть более
высокой. Наиболее характерны для
высокотемпературной газовой коррозии
взаимодействия металлов с окислителями
через пленки твердых продуктов коррозии.
Если пленка сплошная, то скорость коррозии
снижается, и тогда пленку называют защитной.
Когда
объем продукта коррозии меньше объема
металла, из которого эта пленка
сформировалась, возникают внутренние
напряжения растяжения, которые являются
причиной разрывов и трещин в пленках. Через
них окислитель свободно проникает к
поверхности металла, и процесс коррозии
продолжается.
Если
объем продукта коррозии значительно больше
объема металла, из которого он образуется,
то в пленке возникают напряжения сжатия,
приводящие к вздутию, которое возможно при
недостаточном сцеплении пленки с металлом.
Отрыв пленки сопровождается сколами,
облегчающими подход окислителя к металлу, и
скорость коррозии возрастает. В тех случаях,
когда пленка хорошо связана с металлом,
силы сжатия обеспечивают скол оксидной
пленки. Часть продукта «выталкивается» и
скорость коррозии также возрастает.
При
расчете припуска на коррозию пользуются законами
окисления[5].
Наиболее
простым линейным законом удается
воспользоваться в тех случаях, когда
продукты коррозии газообразны либо пленки
продуктов несплошные. Параболический закон
соответствует условиям коррозии, когда
скорость ее определяется диффузией частиц
окислителя и металла через достаточно
толстую пленку продуктов их
взаимодействия. Логарифмический закон
характеризует окисление металлов с высокой
жаростойкостью, на поверхности которых
формируются тонкие пленки продуктов
коррозии.
Примечания
Защита
металлов,1980, №4, с. 478.
478.
Защита
металлов, 1975, т.11, с.211.
Защита
металлов, 1980, №4, с.478.
Наиболее
общими из них являются линейный (M
= kt),
параболический (M2
(M2
= at)
и логарифмический M = blg(gt
+ 1), где M
– количество прореагировавшего металла, k,
a,
b,
g
и n –
константы в уравнениях, описывающих
скорость окисления, t
– продолжительность процесса.
Продолжение
Содержание
Процесс коррозии железа. Химическая коррозия, электрохимическая коррозия, элетрокоррозия
Процесс коррозии железа чаще всего сводится к его окислению кислородом воздуха или кислотами, содержащимися в растворах, и превращению его в оксиды. Коррозия металлов (ржавление) вызывается окислительно-восстановительными реакциями, протекающими на границе металла и окружающей среды. В зависимости от механизма возникновения, различают такие виды коррозии железа, как: химическая, электрохимическая и электрическая.
Коррозия металлов (ржавление) вызывается окислительно-восстановительными реакциями, протекающими на границе металла и окружающей среды. В зависимости от механизма возникновения, различают такие виды коррозии железа, как: химическая, электрохимическая и электрическая.
Процесс химической коррозии железа
Окислительно-восстановительные реакции в данном случае проходят через переход электронов на окислитель. В процессе коррозии такого типа кислород воздуха взаимодействует с поверхностью железа. При этом образуется оксидная пленка, которая называется ржавчиной:
3Fe + 2O2 = Fe3O4 (FeO•Fe2O3)
В отличие от плотно прилегающих оксидных пленок, которые образуются в процессе коррозии на щелочных металлах, алюминии, цинке, рыхлая оксидная пленка на железе свободно пропускает к поверхности металла кислород воздуха, а также другие газы и пары воды. Это способствует дальнейшей коррозии железа.
Процесс электрохимической коррозии
Этот вид коррозии проходит в среде, которая проводит электрический ток. Металл в грунте подвергается, преимущественно, электрохимической коррозии. Процесс коррозии такого типа – это результат химических реакций с участием компонентов окружающей среды. Также электрохимическая коррозия возникает в случае контакта металлов, находящихся в ряду напряжений на некотором расстоянии друг от друга, в результате чего возникает гальваническая пара катод-анод.
Металл в грунте подвергается, преимущественно, электрохимической коррозии. Процесс коррозии такого типа – это результат химических реакций с участием компонентов окружающей среды. Также электрохимическая коррозия возникает в случае контакта металлов, находящихся в ряду напряжений на некотором расстоянии друг от друга, в результате чего возникает гальваническая пара катод-анод.
Атмосферный и грунтовый процесс коррозии выражается схемой:
Fe + O2 + H2O → Fe2O3 · xH2O
В результате образуется ржавчина различной расцветки, что обусловлено тем, что образуются различные окислы железа. Какое именно вещество образуется в процессе коррозии железа, зависит от давления кислорода, влажности воздуха, температуры, длительности процесса, состава железного сплава, состояния поверхности изделия и т. д. Скорость разрушения разных металлов различна.
Процесс коррозии металла в растворах электролитов – это результат работы большого количества микроскопических гальванических элементов, у которых в качестве катода выступают примеси в металле, а в качестве анода – сам металл. В результате чего возникают микроскопические гальванические элементы.
В результате чего возникают микроскопические гальванические элементы.
Также атомы железа на разных участках имеют различную способность отдавать электроны (окисляться). Участки металла, на котором протекает этот процесс, выступают в роли анода. Остальные участки – катодные, на которых происходят процессы восстановления воды и кислорода:
H2O + 2e– = 2OH– + H2↑
O2 + 2H2O + 4e– = 4OH–
Результат – из ионов железа (II) и гидроксид-ионов образуется гидроксид железа (II). Далее идет его окисление до гидроксида железа (III) – основного компонента ржавчины:
Fe2+ + 2OH– = Fe(OH)2
Fe(OH)2 + O2 + H2O → Fe2O3 · xH2O
Для того чтобы гальванический элемент работал, необходимо наличие двух металлов различной химической активности и среды, которая проводит электрический ток, – электролита. При контакте железа и другого металла (например, цинка) коррозия железа замедляется, а более активного металла (цинка) – ускоряется. Это обусловлено тем, что поток электронов идет от более активного металла (анода) к менее активному металлу (катоду). Так, при контакте железа с менее активным металлом, коррозия железа ускоряется.
При контакте железа и другого металла (например, цинка) коррозия железа замедляется, а более активного металла (цинка) – ускоряется. Это обусловлено тем, что поток электронов идет от более активного металла (анода) к менее активному металлу (катоду). Так, при контакте железа с менее активным металлом, коррозия железа ускоряется.
Процесс электрической коррозии
Такой вид разрушения металлических подземных конструкций, кабелей и сооружений могут вызывать блуждающие токи, исходящие от трамваев, метро, электрических железных дорог и различных электроустановок с постоянным током.
Ток с металлических конструкций выходит в грунт в виде положительных ионов металла – происходит электролиз металла. Участок выхода токов – это анодные зоны. Именно в них и протекают активные процессы электрической коррозии железа. Блуждающие токи могут достигать 300 А и действовать в радиусе нескольких десятков километров.
Блуждающими токами, исходящими от источников переменного тока, вызывается слабая коррозия подземных стальных конструкций, и сильная – конструкций из цветных металлов.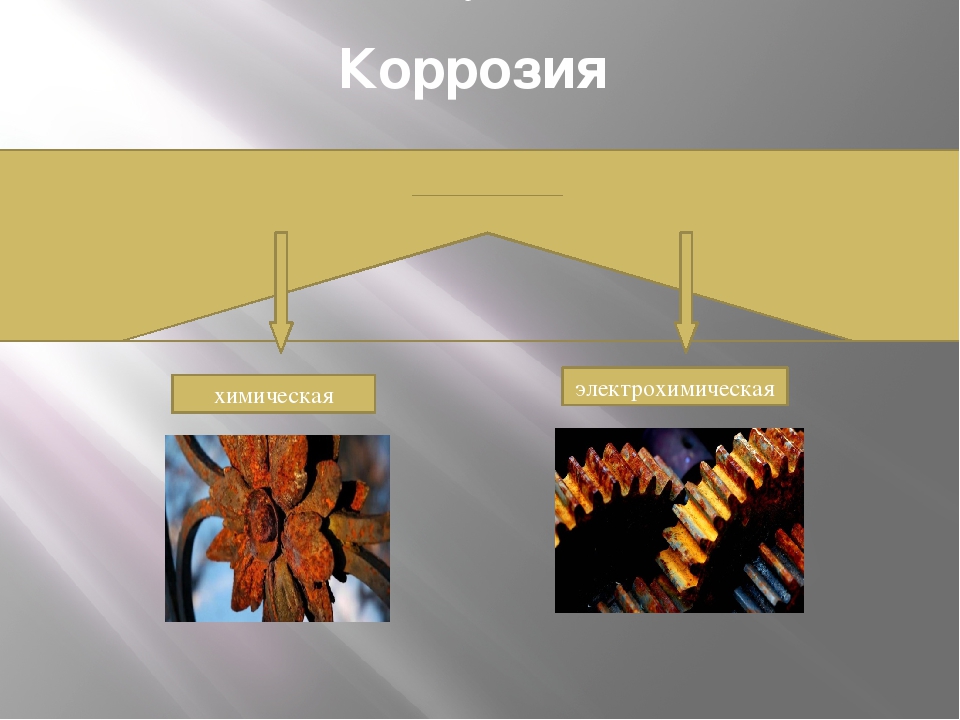 Защита металлических конструкций от коррозии является очень важной задачей, так как она причиняет огромные убытки.
Защита металлических конструкций от коррозии является очень важной задачей, так как она причиняет огромные убытки.
Коррозия металлов и способы защиты от неё
Коррозия – разрушение поверхности сталей и сплавов под воздействием различных физико-химических факторов – наносит огромный ущерб деталям и металлоконструкциям. Ежегодно этот невидимый враг «съедает» около 13 млн. т металла. Для сравнения – металлургическая промышленность стран Евросоюза в прошлом, 2014 году произвела всего на 0,5 млн. тонн больше. И это только – прямые потери. А длительная эксплуатация стальных изделий без их эффективной защиты от коррозии вообще невозможна.
Что такое коррозия и её разновидности
Основной причиной интенсивного окисления поверхности металлов (что и является основной причиной коррозии) являются:
- Повышенная влажность окружающей среды.
- Наличие блуждающих токов.
- Неблагоприятный состав атмосферы.

Соответственно этому различают химическую, трибохимическую и электрохимическую природу коррозии. Именно они в совокупности своего влияния и разрушают основную массу металла.
Химическая коррозия
Такой вид коррозии обусловлен активным окислением поверхности металла во влажной среде. Безусловным лидером тут является сталь (исключая нержавеющую). Железо, являясь основным компонентом стали, при взаимодействии с кислородом образует три вида окислов: FeO, Fe2O3 и Fe3O4. Основная неприятность заключается в том, что определённому диапазону внешних температур соответствует свой окисел, поэтому практическая защита стали от коррозии наблюдается только при температурах выше 10000С, когда толстая плёнка высокотемпературного оксида FeO сама начинает предохранять металл от последующего образования ржавчины. Это процесс называется воронением, и активно применяется в технике для защиты поверхности стальных изделий. Но это – частный случай, и таким способом активно защищать металл от коррозии в большинстве случаев невозможно.
Но это – частный случай, и таким способом активно защищать металл от коррозии в большинстве случаев невозможно.
Химическая коррозия активизируется при повышенных температурах. Склонность металлов к химическому окислению определяется значением их кислородного потенциала – способности к участию в окислительно-восстановительных реакциях. Сталь – ещё не самый худший вариант: интенсивнее её окисляются, в частности, свинец, кобальт, никель.
Электрохимическая коррозия
Эта разновидность коррозии более коварна: разрушение металла в данном случае происходит при совокупном влиянии воды и почвы на стальную поверхность (например, подземных трубопроводов). Влажный грунт, являясь слабощёлочной средой, способствует образованию и перемещению в почве блуждающих электрических токов. Они являются следствием ионизации частиц металла в кислородсодержащей среде, и инициирует перенос катионов металла с поверхности вовне. Борьба с такой коррозией усложняется труднодоступностью диагностирования состояния грунта в месте прокладки стальной коммуникации.
Борьба с такой коррозией усложняется труднодоступностью диагностирования состояния грунта в месте прокладки стальной коммуникации.
Электрохимическая коррозия возникает при окислении контактных устройств линий электропередач при увеличении зазоров между элементами электрической цепи. Помимо их разрушения, в данном случае резко увеличивается энергопотребление устройств.
Трибохимическая коррозия
Данному виду подвержены металлообрабатывающие инструменты, которые работают в режимах повышенных температур и давлений. Антикоррозионное покрытие резцов, пуансонов, фильер и пр. невозможно, поскольку от детали требуется высокая поверхностная твёрдость. Между тем, при скоростном резании, холодном прессовании и других энергоёмких процессах обработки металлов начинают происходить механохимические реакции, интенсивность которых возрастает с увеличением температуры на контактной поверхности «инструмент-заготовка». Образующаяся при этом окись железа Fe2O3 отличается повышенной твёрдостью, и поэтому начинает интенсивно разрушать поверхность инструмента.
Методы борьбы с коррозией
Выбор подходящего способа защиты поверхности от образования ржавчины определяется условиями, в которых работает данная деталь или конструкция. Наиболее эффективны следующие методы:
- Нанесение поверхностных атмосферостойких покрытий;
- Поверхностная металлизация;
- Легирование металла элементами, обладающими большей стойкостью к участию в окислительно-восстановительных реакциях;
- Изменение химического состава окружающей среды.
Механические поверхностные покрытия
Поверхностная защита металла может быть выполнена его окрашиванием либо нанесением поверхностных плёнок, по своему составу нейтральных к воздействию кислорода. В быту, а также при обработке сравнительно больших площадей (главным образом, подземных трубопроводов) применяется окраска. Среди наиболее стойких красок – эмали и краски, содержащие алюминий. В первом случае эффект достигается перекрытием доступа кислороду к стальной поверхности, а во втором – нанесением алюминия на поверхность, который, являясь химически инертным металлом, предохраняет сталь от коррозионного разрушения.
Положительными особенностями данного способа защиты являются лёгкость его реализации и сравнительно небольшие финансовые затраты, поскольку процесс достаточно просто механизируется. Вместе с тем долговечность такого способа защиты невелика, поскольку, не обладая большой степенью сродства с основным металлом, такие покрытия через некоторое время начинают механически разрушаться.
Химические поверхностные покрытия
Коррозионная защита в данном случае происходит вследствие образования на поверхности обрабатываемого металла химической плёнки, состоящей из компонентов, стойких к воздействию кислорода, давлений, температур и влажности. Например, углеродистые стали обрабатывают фосфатированием. Процесс может выполняться как в холодном, так и в горячем состоянии, и заключается в формировании на поверхности металла слоя из фосфатных солей марганца и цинка. Аналогом фосфатированию выступает оксалатирование – процесс обработки металла солями щавелевой кислоты. Применением именно таких технологий повышают стойкость металлов от трибохимической коррозии.
Недостатком данных методов является трудоёмкость и сложность их применения, требующая наличия специального оборудования. Кроме того, конечная поверхность изменяет свой цвет, что не всегда приемлемо по эстетическим соображениям.
Легирование и металлизация
В отличие от предыдущих способов, здесь конечным результатом является образование слоя металла, химически инертного к воздействию кислорода. К числу таких металлов относятся те, которые на линии кислородной активности находятся возможно дальше от водорода. По мере возрастания эффективности этот ряд выглядит так: хром→медь→цинк→серебро→алюминий→платина. Различие в технологиях получения таких антикоррозионных слоёв состоит в способе их нанесения. При металлизации на поверхность направляется ионизированный дуговой поток мелкодисперсного напыляемого металла, а легирование реализуется в процессе выплавки металла, как следствие протекания металлургических реакций между основным металлом и вводимыми легирующими добавками.
Изменение состава окружающей среды
В некоторых случаях существенного снижения коррозии удаётся добиться изменением состава атмосферы, в которой работает защищаемая металлоконструкция. Это может быть вакуумирование (для сравнительно небольших объектов), или работа в среде инертных газов (аргон, неон, ксенон). Данный метод весьма эффективен, однако требует дополнительного оборудования — защитных камер, костюмов для обслуживающего персонала и т.д. Используется он главным образом, в научно-исследовательских лабораториях и опытных производствах, где специально поддерживается необходимый микроклимат.
Кто нам мешает, тот нам поможет
В завершение укажем и на довольно необычный способ коррозионной защиты: с помощью самих окислов железа, точнее, одного из них — закиси-окиси Fe3O4. Данное вещество образуется при температурах 250…5000С и по своим механическим свойствам представляет собой высоковязкую технологическую смазку. Присутствуя на поверхности заготовки, Fe3O4 перекрывает доступ кислороду воздуха при полугорячей деформации металлов и сплавов, и тем самым блокирует процесс зарождения трибохимической коррозии. Это явление используется при скоростной высадке труднодеформируемых металлов и сплавов. Эффективность данного способа обусловлена тем, что при каждом технологическом цикле контактные поверхности обновляются, а потому стабильность процесса регулируется автоматически.
Основные виды коррозии металлов | «ЧелМетСнаб»
Содержание:
Коррозией металлов называется их разрушение вследствие химического или электрохимического взаимодействия с окружающей средой. По механизму протекания процесса различают два типа коррозии металлов: химическую и электрохимическую.
Химическая коррозия — это коррозийный процесс, протекающий в средах, не проводящий электрический ток. Химическая коррозия имеет место, например, при высокотемпературном нагреве стали для горячей обработки давлением или термической обработки. При этом на поверхности металла образуются различные химические соединения — оксиды, сульфиды и другие — в виде пленки.
В отдельных случаях образовавшиеся при химической коррозии пленки, особенно сплошные, предохраняют металл от дальнейшей коррозии. Например, алюминий, олово, свинец, никель и хром способны к образованию на поверхности металлов плотных защитных пленок. пленки же на поверхности стальных и чугунных изделий непрочны, способны к растрескиванию и проникновению коррозии в глубь металла.
Электрохимическая коррозия обычно сопровождается протеканием электрического тока. Примерами могут служить ржавление металлических конструкций и изделий в атмосфере, корпусов судов и стальной арматуры гидросооружений в речной и морской воде и т.п.
Детальное рассмотрение механизмов химической и электрохимической коррозии показывает, что резкого различия между ними не существует. В ряде случаев возможен постепенный переход химической коррозии в электрохимическую и, наоборот, механизм коррозии металлов в растворах электролитов может иметь двоякий характер.
Коррозия по условиям протекания бывает следующая. Газовая- коррозия металла в газах при высоких температурах. Коррозия в неэлектролитах (например, коррозия стали в бензине). Атмосферная коррозия различных металлических конструкций на воздухе. Коррозия в электролитах- в проводящих электрический ток жидких средах. Почвенная (например, коррозия подземных трубопроводов). Коррозия внешним током или электрокоррозия (например, коррозия подземной трубы блуждающими токами). Контактная — электрохимическое разрушение металлов, происходящее в результате контакта различных металлов в электролите (например, коррозия деталей из алюминиевых сплавов, соприкасающихся с деталями из меди). Структурная- связанная со структурной неоднородностью металлов; например, ускорение коррозионного процесса чугуна в растворе серной кислоты в результате имеющихся в нем включений графита. Коррозия под напряжением, изменяющимся по значению и знаку, что часто вызывает коррозионную усталость- понижение предела выносливости металла. Коррозия при трении; например, разрушение шейки вала при вращении в морской воде. Щелевая, протекающая в узких щелях и зазорах между отдельными деталями. Биокоррозия- коррозия металлов под воздействием продуктов, выделяемых микроорганизмами, и пота рук человека. По характеру коррозионных процессов и месту их распределения различают сплошную, местную и межкристаллитную коррозию. Сплошная коррозия характеризуется тем, что металлическое изделие разрушается почти равномерно и коррозия охватывает всю его поверхность. Этот вид коррозии сравнительно легко поддается контролю и оценке.
Местная коррозия обычно бывает сосредоточенна на отдельных участках поверхности изделия. Это более опасный вид коррозии, так как распространяется на значительную глубину, а следовательно, приводит к потере работоспособности изделий. Чаще всего этот вид коррозии наблюдается в местах механических повреждений поверхности изделий. При межкристаллитной коррозии процесс разрушения начинается с поверхности изделия и распространяется в глубь его, в основном по границам зерен. Межкристаллитная коррозия вызывает хрупкость металла и значительное снижение его несущей способности. Этот часто встречающийся на практике вид коррозии является весьма опасным и обычно имеет место при термической обработке металлов или сварке. Степень коррозийной стойкости сталей существенно зависит от содержания углерода. Так, с уменьшением содержания углерода в легированной хромоникелевой стали марки Х18Н9 до 0.015% практически устраняется склонность ее к межкристаллитной коррозии.
Методы защиты металлов от коррозии, их эффективность
Существуют многочисленные способы защиты металлов от коррозии. Выбор того или иного способа определяется конкретными условиями работы и хранения металлических изделий. Применяются следующие способы защиты: легирование сталей, нанесение металлических покрытий, электрохимическая защита.
Легирование наиболее надежно защищает металл от коррозии, причем наиболее эффективно в условиях воздействия механических напряжений и коррозийной среды. Легирование позволяет предотвратить и коррозийное растрескивание изделий.
Так, например, к группе сталей с особыми химическими свойствами относят коррозионно-стойкие стали. Их получают путем введения в углеродистые и низколегированные стали значительных добавок хрома или хрома и никеля. При содержании хрома 13, 17 и 25% хромистые стали являются не только коррозионно-, но и жаростойкими. Хромоникелевые стали обладают большей коррозионной стойкостью, чем хромистые, и находят широкое применение в химической промышленности.
Механизм защиты сталей от коррозии их легированием различен и связан либо с повышением коррозионной стойкости всего объема металла, либо с образованием на поверхности изделия защитных пленок.
Металлические покрытия наносят на поверхность изделия тонким слоем металла, обладающего достаточной стойкостью в данной среде. Металлические покрытия придают также поверхностным слоям металлоизделий требуемую твердость, износостойкость. Различают два типа металлических покрытий- анодное и катодное. Для железоуглеродистых сплавов таким анодным покрытием может служить покрытие из цинка и кадмия. В воде и во влажном воздухе цинк покрывается слоем основной углекислой соли белого цвета, защищающим его от дальнейшего разрушения. Широкое применение получили цинковые покрытия для защиты арматуры, труб и резервуаров от действия воды и горячих жидкостей.
Металлические покрытия наносят различными способами. Наиболее часто применяется горячий метод, гальванизация и металлизация.
При горячем методе изделие погружают в расплавленный металл, который смачивает его поверхность и покрывает тонким слоем. Затем изделие вынимают из ванны и охлаждают. Таким методом изделие покрывают слоем олова или цинка. Лужение применяют при изготовлении белой жести, при устройстве покрытий на внутренних поверхностях пищевых котлов и других изделий. Цинкованием предохраняют от коррозии, например, кровельное железо, водопроводные трубы.
При гальваническом способе металлические изделия помещают в гальваническую ванну. Под действием электрического тока на поверхности изделия происходит катодное осаждение пленки защитного металла. Толщину гальванического покрытия можно регулировать в широких пределах. Покрытия получают также распылением расплавленного металла с помощью специальных металлизационных пистолетов и напылением на его поверхность защищаемого металла. Этот вид защиты используют для крупногабаритных конструкций: ж./д мостов и т. д. В качестве защитного металла используют алюминий, цинк, хром, коррозионно-стойкие стали.
Неметаллические покрытия выполняются из лаков, красок, эмалей и др. веществ и изолируют изделие от воздействия внешней среды. Эти покрытия имеют преимущество перед металлическими. Они легко наносятся на изделие, хорошо закрывают поры, не изменяют свойств металла и являются относительно дешевыми. При хранении и перевозке изделий металлические изделия покрывают специальными смазочными материалами, минеральными маслами и жирами. Для защиты изделий, работающих в высокоагрессивных средах, применяют пластмассовые покрытия из винипласта, поливинилхлорида.
Химические покрытия — защитные оксидные иные пленки- создаются при воздействии на металл сильных химических реагентов. Широко применяются также оксидирование и фосфатирование металлоизделий.
Оксидирование заключается в создании на поверхности изделия оксидной пленки, обладающей большой коррозийной стойкостью. Наиболее широко применяют оксидирование для защиты от коррозии изделий из алюминия и его сплавов.
Фосфатирование стальных изделий заключается в создании поверхностного слоя из фосфатов марганца и железа. Фосфатные покрытия используются в дальнейшем в качестве подслоя. Фосфатные покрытия часто применяются в сочетании со смазочными материалами для уменьшения трения при обработке металлов давлением, волочением, для хорошей приработке трущихся деталей машин.
В отдельных случаях прибегают к защите металлов от коррозии при помощи протекторов. Сущность протекторной защиты заключается в том, что к поверхности защищаемого изделия прикрепляют протекторы- куски металла. Образуется гальваническая пара , в которой анод- протектор, катод- изделие. В результате протектор разрушается, защищая изделие. Таким образом, защищают, например, подводные металлические части кораблей, прикрепляя к ним пластины цинка.
Возможно вас заинтересует
Народнохозяйственное значение борьбы с коррозией
Одним из основных факторов, определяющих долговечность машин и оборудования, является коррозия металлов. Потери от коррозии можно разделить на прямые и косвенные. Прямые потери- это стоимость заменяемых изделий, затраты на защитные мероприятия и безвозвратные потери металла вследствие коррозии. По подсчетам специалистов, безвозвратные потери металла в мировом масштабе составляют в настоящее время около 10…15% от объема производства стали. Косвенные потери продукта в результате утечек, снижение производительности агрегата, загрязнение продуктами коррозии целевого продукта и т.п.
Значительная часть мощности предприятий черной металлургии затрачивается на восполнение потерь металла вследствие коррозии. Однако это далеко не полностью отражает действительный ущерб, связанный с выходом из строя изделий из металла. Значительные потери обусловлены авариями оборудования, простоями его, потерями и отходами в металлообработке, нарушениями качества продукции и в конечном счете повышением ее себестоимости и снижением производительности труда. Поэтому экономия металла, повышение качества металлов и металлоизделий, уменьшение коррозионных потерь — непременное условие повышения эффективности производства и качества продукции, которое должно обеспечиваться в государственном масштабе.
Типы и причины коррозии, способы ее предотвращения Блоги по решениям для ходовых и управляющих систем
Предотвращение коррозии — важнейшая задача во многих отраслях промышленности. В отсутствие защитных мер коррозия может оказать пагубное влияние на инфраструктуру, а также безопасность и эффективность бизнеса. Риску подвержен и бюджет компаний: по результатам исследования, проведенного организацией NACE International, ежегодные затраты на борьбу с коррозией составляют 2,5 триллиона долл. США.
С другой стороны, современным инженерам-конструкторам доступно значительно больше инструментов, чем прежде. Более глубокое понимание типов и причин коррозии, усовершенствованные материалы и передовые подходы — все это помогает техническим специалистам предотвращать разрушение металлов и снижать его интенсивность.
В этой публикации представлено краткое содержание новой брошюры Parker о борьбе с коррозией.
Определение коррозии
Коррозия — это процесс, при котором инфраструктура, продукция и детали разрушаются вследствие химической либо электрохимической реакции с окружающей средой.
Основные типы коррозии
Сегодня в разных отраслях промышленности распространены шесть типов коррозии.
• Электрохимическая коррозия, возникающая при контакте двух материалов с разными электрохимическими свойствами (например, сталь и латунь) в агрессивной среде и приводящая к разрушению менее устойчивого материала.
• Точечная коррозия, при которой в металле быстро возникают глубокие и узкие отверстия, в то время как остальная поверхность остается неповрежденной. Обычно это происходит с самопассивирующимися материалами, такими как нержавеющая сталь или сплавы алюминия.
• Равномерная коррозия, которая развивается постепенно на открытой для воздействия поверхности металла, оставляя равномерный слой отложений.
• Щелевая коррозия, охватывающая те участки, где в небольших углублениях (выемках или углах) скапливается жидкость.
• Межкристаллитная коррозия, которая возникает внутри зернистой структуры сплава или рядом с ней и вызывает локальные повреждения.
• Коррозионное растрескивание под напряжением, когда материал подвергается непрерывной или меняющейся нагрузке в агрессивной среде, что приводит к появлению трещин.
Что вызывает коррозию?
Коррозия — результат воздействия ряда различных факторов, характерных для каждой конкретной отрасли. Ниже перечислены распространенные примеры для отдельных отраслей.
• В сфере строительства коррозия часто возникает в ситуациях, когда металлы подвергаются воздействию природных факторов и экстремальных температур.
• Подземные разработки обычно проводят в средах с кислой водой (нередко содержащей хлориды и сульфаты) в сочетании с высокой влажностью и температурой.
• В лесной промышленности коррозия обычно появляется при работе на удаленных участках, когда оборудование паркуют прямо на траве или земле. За ночь там накапливается большое количество воды, которая может вызывать коррозию встроенных механических систем и компонентов.
Условия окружающей среды также влияют на скорость развития и распространение коррозии. При повышенной влажности металлы реагируют друг с другом и разрушаются гораздо быстрее, чем в сухих условиях.
В агрессивных средах обычно присутствуют следующие факторы (отдельно или в различных сочетаниях):
• влажность;
• экстремальные температуры;
• сырые поверхности;
• взвешенные в воздухе частицы;
• соль;
• промышленные смазочные материалы.
Предотвращение коррозии и защита
Инженерам доступен целый ряд методов, которые помогают снизить интенсивность коррозии или предотвратить ее возникновение. Ниже перечислены методы, более подробно описанные в брошюре о борьбе с коррозией.
• Выбор материалов. Ключевую роль играет выбор подходящих материалов с учетом задачи и условий ее выполнения. В агрессивной среде разрушению подвержены все металлы, однако сплавы могут резко отличаться друг от друга по своим показателям. Решающее значение в этом случае имеет баланс между пределом прочности на разрыв и стойкостью к нагреву, воздействию химических веществ и коррозии.
• Совместимость материалов. При разработке продуктов инженеры должны учитывать вероятность соприкосновения потенциально несовместимых материалов. Так, сочетания меди и нержавеющей стали или бронзы и стали могут стать причиной электрохимической коррозии. Для решения этой проблемы следует выбирать совместимые материалы и сплавы либо применять изоляцию, которая позволяет предотвратить образование электрической цепи.
• Защитные покрытия. На некоторые металлы, такие как сталь, железо и алюминий, можно нанести защитное покрытие, устойчивое к коррозии. Чтобы выбрать оптимальную комбинацию металла и покрытия, требуется тщательно проанализировать требования к прочности, надежности, трению, моменту затяжки и коррозионной стойкости.
• Коррозионные испытания. В ходе контролируемых испытаний можно смоделировать различные агрессивные атмосферы, включая распыленную соленую воду, солевой туман, сухость и влажность. Такие испытания обычно проводят с соблюдением очень точных параметров, например моделируют сезонные циклы, чтобы воссоздать реальные погодные условия.
• Системы защиты от коррозии. Эффективная система защиты помогает предприятиям успешно справляться с коррозией. Мониторинг состояния и анализ журналов для учета инцидентов улучшают понимание практических аспектов, связанных с коррозией, а обмен информацией между подразделениями позволяет выявить потенциальную зависимость между капиталовложениями, методами обслуживания и сроком службы активов.
Борьба с коррозией: брошюра
Скачать брошюру
Автор статьи — доктор Филипп Вагенер (Philipp Wagener)
Связанные статьи:
Пыль гораздо вреднее, чем кажется
16.8: Электрохимическая коррозия — Chemistry LibreTexts
Цели обучения
Убедитесь, что вы полностью понимаете следующие важные идеи. Особенно важно, чтобы вы знали точное значение всех выделенных терминов в контексте этой темы.
- Электрохимическая коррозия металлов происходит, когда электроны от атомов на поверхности металла переносятся на подходящий акцептор электронов или деполяризатор . Должна присутствовать вода, чтобы служить средой для переноса ионов.
- Наиболее распространенными деполяризаторами являются кислород, кислоты и катионы менее активных металлов.
- Поскольку электроны проходят через сам металлический объект, анодная и катодная области (две половины электрохимической ячейки) могут находиться на значительном расстоянии друг от друга.
- Анодные области имеют тенденцию развиваться в местах, где металл подвергается напряжению или защищен от кислорода.
- Контакт с другим металлом, прямой или косвенный, может привести к коррозии более активного металла.
- Коррозию стали можно предотвратить путем цинкования , то есть путем покрытия ее цинком, более активным металлом, растворение которого оставляет на металле отрицательный заряд, который препятствует дальнейшему растворению Fe 2+ .
- Катодная защита с использованием внешнего источника напряжения широко используется для защиты подземных сооружений, таких как резервуары, трубопроводы и опоры. Источником может быть расходуемый анод из цинка или алюминия, либо сетевой или фотоэлектрический источник питания.
Коррозию можно определить как разрушение материалов химическими процессами. Из них наиболее важной на сегодняшний день является электрохимическая коррозия металлов, в которой процесс окисления M → M + + e — облегчается наличием подходящего акцептора электронов, иногда называемого в коррозионной науке как . деполяризатор.
В некотором смысле коррозию можно рассматривать как самопроизвольное возвращение металлов в свои руды; Огромное количество энергии, затраченной на добычу, очистку и производство металлов в полезные объекты, рассеивается множеством различных маршрутов.Экономические аспекты коррозии намного важнее, чем думает большинство людей; ориентировочная стоимость коррозии только в США составила 276 миллиардов долларов в год. Из этой суммы около 121 миллиарда долларов было потрачено на борьбу с коррозией, а разница в 155 миллиардов долларов осталась чистой убытком для экономики. Коммунальные предприятия, особенно системы питьевого водоснабжения и канализации, несут наибольший экономический ущерб, за которыми следуют автомобили и транспорт.
Ячейки коррозии и реакции
Особенностью большинства процессов коррозии является то, что стадии окисления и восстановления происходят в разных местах металла.Это возможно, потому что металлы являются проводящими, поэтому электроны могут течь через металл из анодной области в катодную (рис. \ (\ PageIndex {1} \)). Присутствие воды необходимо для переноса ионов к металлу и от него, но может быть достаточно тонкой пленки адсорбированной влаги.
Рисунок \ (\ PageIndex {1} \): Коррозия — это двухэтапный процесс. Рисунок \ (\ PageIndex {1} \): Электрохимическая коррозия железа. Коррозия часто начинается в месте (1), где металл находится под напряжением (на изгибе или сварке) или изолирован от воздуха (где два куска металла соединены или находятся под неплотно приставшей пленкой краски.) Ионы металлов растворяются в пленке влаги, а электроны мигрируют в другое место (2), где они захватываются деполяризатором . {-}} \ label {1.{-}} \ rightarrow \ ce {M (s)} \ label {1.7.2c} \]
где \ (\ ce {M} \) — металл.
Какие части металла служат анодами и катодами, может зависеть от многих факторов, как видно из обычно наблюдаемых нерегулярных структур коррозии. Атомы в областях, которые подверглись напряжению, которое может быть получено при формовании или механической обработке, часто имеют более высокую свободную энергию и, следовательно, имеют тенденцию становиться анодными.
Рисунок \ (\ PageIndex {2} \): Принципиальная схема ячеек коррозии железа.(CC BY-NSA-NC; анонимно по запросу)
Если одна часть металлического объекта защищена от атмосферы так, что \ (\ ce {O2} \) недостаточно для создания или поддержания оксидной пленки, это «защищает «регион часто будет местом, где коррозия наиболее активна. Тот факт, что такие участки обычно скрыты от глаз, во многом объясняет сложность обнаружения и контроля коррозии.
Рисунок \ (\ PageIndex {3} \): Точечная коррозия Большинство металлов покрыто тонкой оксидной пленкой, которая препятствует анодному растворению.Когда происходит коррозия, иногда в металле образовывается узкое отверстие или ямка. Дно этих ям, как правило, лишено кислорода, что способствует дальнейшему врастанию ямы в металл. (CC BY 3.0 Unported; Стивен Лоуэр)
В отличие от анодных участков, которые, как правило, локализуются в определенных областях поверхности, катодная часть процесса может происходить практически где угодно. Поскольку оксиды металлов обычно являются полупроводниками, большинство оксидных покрытий не препятствуют потоку электронов к поверхности, поэтому почти любая область, которая подвергается воздействию \ (\ ce {O2} \) или какого-либо другого акцептора электронов, может действовать как катод.Склонность участков, лишенных кислорода, становиться анодными, является причиной многих часто наблюдаемых видов коррозии.
Ржавые пятна от автомобилей и ванных комнат
Любой, кто владел старым автомобилем, видел коррозию на стыках между частями кузова и под пленкой краски. Вы также заметили, что как только начинается коррозия, она начинает питаться сама собой. Одна из причин этого заключается в том, что одним из продуктов реакции восстановления O 2 является ион гидроксида. Высокий pH, возникающий в этих катодных областях, имеет тенденцию разрушать защитную оксидную пленку и может даже смягчить или ослабить пленки краски, так что эти участки могут стать анодными.Большее количество электронов способствует более интенсивному катодному действию, которое порождает еще больше анодных участков и т. Д.
Рисунок \ (\ PageIndex {4} \): Ржавый автомобиль. Сильно проржавевшие половицы Chrysler New Yorker 1990 года выпуска. Автомобиль был поврежден до такой степени, что управлять им стало небезопасно. Под ржавым участком между двумя отверстиями были две тормозные магистрали (Public Domain; Bige1977 через Википедию).
Очень распространенной причиной коррозии является контакт двух разнородных металлов, что может произойти рядом с крепежным элементом или в сварном шве.Влага собирается в точке соединения, действуя как электролит и образуя ячейку, в которой два металла служат электродами. {-}}.\]
Метод защиты 1: Жертвенные покрытия
Один из способов снабжения этого отрицательного заряда — нанесение покрытия из более активного металла. Таким образом, очень распространенный способ защиты стали от коррозии — покрытие ее тонким слоем цинка; Этот процесс известен как цинкование. Цинковое покрытие, которое менее благородно, чем железо, имеет тенденцию к избирательной коррозии. Растворение этого жертвенного покрытия оставляет после себя электроны, которые концентрируются в железе, делая его катодным и, таким образом, препятствуя его растворению.
Рисунок \ (\ PageIndex {5} \): Жертвенные покрытия (CC BY 3.0 Unported; Стивен Лоуэр)
Эффект покрытия железа менее активным металлом обеспечивает интересный контраст. Обычная луженая банка (справа) — хороший тому пример. Пока оловянное покрытие остается неповрежденным, все в порядке, но воздействие влажной атмосферы даже на крошечную часть лежащего под ним железа вызывает коррозию. Электроны, высвобождаемые из железа, перетекают в олово, делая его более анодным, поэтому теперь олово активно способствует коррозии железа! Вы, наверное, наблюдали, как жестяные банки очень быстро разрушаются, когда их оставляют на открытом воздухе.
Метод защиты 2: катодная защита
Более сложная стратегия заключается в поддержании постоянного отрицательного электрического заряда на металле, чтобы предотвратить его растворение в виде положительных ионов. Поскольку вся поверхность приводится в катодное состояние, этот метод известен как катодная защита . Источником электронов может быть внешний источник постоянного тока (обычно используемый для защиты нефтепроводов и других подземных сооружений), или это может быть коррозия другого, более активного металла, такого как кусок цинка или алюминия, закопанный в землю поблизости. , как показано на иллюстрации подземного резервуара для хранения пропана ниже.
Рисунок \ (\ PageIndex {6} \): Катодная защита (CC BY 3.0, без порта; Стивен Лоуэр)
20.8: Коррозия — Chemistry LibreTexts
Цели обучения
- Чтобы понять процесс коррозии.
Коррозия — это гальванический процесс, при котором металлы разрушаются в результате окисления — обычно, но не всегда, до их оксидов. Например, при воздействии воздуха ржавчина железа, потускнение серебра, а также медь и латунь приобретают голубовато-зеленую поверхность, называемую патиной.Из различных металлов, подверженных коррозии, железо является наиболее важным с коммерческой точки зрения. По оценкам, только в Соединенных Штатах ежегодно тратится 100 миллиардов долларов на замену железосодержащих объектов, разрушенных коррозией. Следовательно, разработка методов защиты металлических поверхностей от коррозии является очень активной областью промышленных исследований. В этом разделе мы описываем некоторые химические и электрохимические процессы, вызывающие коррозию. Мы также исследуем химическую основу некоторых распространенных методов предотвращения коррозии и обработки корродированных металлов.
Коррозия — это РЕДОКС-процесс.
В условиях окружающей среды окисление большинства металлов является термодинамически самопроизвольным, за исключением золота и платины. Поэтому на самом деле несколько удивительно, что какие-либо металлы вообще полезны во влажной, богатой кислородом атмосфере Земли. Однако некоторые металлы устойчивы к коррозии по кинетическим причинам. Например, алюминий в банках для безалкогольных напитков и в самолетах защищен тонким слоем оксида металла, который образуется на поверхности металла и действует как непроницаемый барьер, предотвращающий дальнейшее разрушение.Алюминиевые банки также имеют тонкий пластиковый слой для предотвращения реакции оксида с кислотой в безалкогольном напитке. Хром, магний и никель также образуют защитные оксидные пленки. Нержавеющие стали отличаются высокой устойчивостью к коррозии, поскольку они обычно содержат значительную долю хрома, никеля или того и другого.
В отличие от этих металлов, когда железо корродирует, оно образует красно-коричневый гидратированный оксид металла (\ (\ ce {Fe2O3 \ cdot xh3O} \)), широко известный как ржавчина, который не обеспечивает плотной защитной пленки (рис. \ (\ PageIndex {1} \)).Вместо этого ржавчина постоянно отслаивается, обнажая поверхность свежего металла, уязвимую для реакции с кислородом и водой. Поскольку для образования ржавчины требуются кислород и вода, железный гвоздь, погруженный в деоксигенированную воду, не ржавеет даже в течение нескольких недель. Точно так же гвоздь, погруженный в органический растворитель, такой как керосин или минеральное масло, не будет ржаветь из-за отсутствия воды, даже если растворитель насыщен кислородом.
Рисунок \ (\ PageIndex {1} \): Ржавчина, результат коррозии металлического железа.Железо окисляется до Fe 2 + (водн.) На анодном участке на поверхности железа, который часто является примесью или дефектом решетки. Кислород восстанавливается до воды в другом месте на поверхности железа, которое действует как катод. Электроны передаются от анода к катоду через электропроводящий металл. Вода является растворителем для Fe 2 + , который образуется изначально и действует как солевой мостик. Ржавчина (Fe 2 O 3 • xH 2 O) образуется в результате последующего окисления Fe 2 + кислородом воздуха.o_ {cell} \) для процесса коррозии (уравнение \ (\ ref {Eq3} \)) указывают на то, что существует сильная движущая сила для окисления железа O 2 в стандартных условиях (1 MH + ) . В нейтральных условиях движущая сила несколько меньше, но все же заметна (E = 1,25 В при pH 7,0). Обычно реакция атмосферного CO 2 с водой с образованием H + и HCO 3 — обеспечивает достаточно низкий pH для увеличения скорости реакции, как и кислотный дождь.Производители автомобилей тратят много времени и денег на разработку красок, которые плотно прилегают к металлической поверхности автомобиля, чтобы предотвратить контакт насыщенной кислородом воды, кислоты и соли с основным металлом. К сожалению, даже самая лучшая краска подвержена царапинам или вмятинам, а электрохимическая природа процесса коррозии означает, что две относительно удаленные друг от друга царапины могут работать вместе как анод и катод, что приводит к внезапному механическому отказу (Рисунок \ (\ PageIndex { 2} \)).
Рисунок \ (\ PageIndex {2} \): Небольшие царапины на защитном лакокрасочном покрытии могут привести к быстрой коррозии железа. Отверстия в защитном покрытии позволяют восстанавливать кислород на поверхности при большем контакте с воздухом (катод), в то время как металлическое железо окисляется до Fe 2 + (водн.) На менее незащищенном участке (анод). Ржавчина образуется, когда Fe 2 + (водный) диффундирует в место, где он может реагировать с атмосферным кислородом, который часто находится далеко от анода.Электрохимическое взаимодействие между катодным и анодным участками может вызвать образование большой ямы под окрашенной поверхностью, что в конечном итоге приведет к внезапному отказу с небольшим видимым предупреждением о том, что произошла коррозия.
Профилактическая защита
Одним из наиболее распространенных методов предотвращения коррозии железа является нанесение защитного покрытия из другого металла, который труднее окисляется. Например, смесители и некоторые внешние детали автомобилей часто покрываются тонким слоем хрома с помощью электролитического процесса.Однако с увеличением использования полимерных материалов в автомобилях использование хромированной стали в последние годы сократилось. Точно так же «жестяные банки», в которых хранятся супы и другие продукты, на самом деле состоят из стального контейнера, покрытого тонким слоем олова. Хотя ни хром, ни олово по своей природе не устойчивы к коррозии, они оба образуют защитные оксидные покрытия, которые препятствуют доступу кислорода и воды к лежащей в основе стали (сплаву железа).
Рисунок \ (\ PageIndex {3} \): Гальваническая коррозия.Если железо контактирует с более стойким к коррозии металлом, таким как олово, медь или свинец, другой металл может действовать как большой катод, что значительно увеличивает скорость восстановления кислорода. Поскольку восстановление кислорода связано с окислением железа, это может привести к резкому увеличению скорости окисления железа на аноде. Гальваническая коррозия может возникнуть, когда два разнородных металла соединены напрямую, что позволяет электронам переноситься от одного к другому.{2 +}} \) (E ° = -0,14 В) и Fe 2 + (E ° = -0,45 В) в таблице P2 показывают, что \ (\ ce {Fe} \) окисляется легче, чем \ (\ ce {Sn} \). В результате более стойкий к коррозии металл (в данном случае олово) ускоряет коррозию железа, действуя как катод и обеспечивая большую площадь поверхности для восстановления кислорода (рисунок \ (\ PageIndex {3} \)). . Этот процесс наблюдается в некоторых старых домах, где медные и железные трубы были напрямую соединены друг с другом. Менее легко окисляемая медь действует как катод, заставляя железо быстро растворяться возле соединения и иногда приводя к катастрофическому отказу водопровода.{2 +} _ {(aq)} + 2H_2O _ {(l)}} _ {\ text {total}} \ label {Eq7} \]
Более химически активный металл вступает в реакцию с кислородом и в конечном итоге растворяется, «жертвуя собой» ради защиты железного объекта. Катодная защита — это принцип, лежащий в основе оцинкованной стали, которая представляет собой сталь, защищенную тонким слоем цинка. Оцинкованная сталь используется в различных предметах, от гвоздей до мусорных баков.
Кристаллическая поверхность горячеоцинкованной стальной поверхности. Это служило как профилактической защитой (защищая нижележащую сталь от кислорода в воздухе), так и катодной защитой (после воздействия цинк окисляется раньше, чем нижележащая сталь).
В аналогичной стратегии, например, расходуемые электроды , в которых используется магний, используются для защиты подземных резервуаров или трубопроводов (Рисунок \ (\ PageIndex {4} \)). Замена расходуемых электродов более рентабельна, чем замена железных предметов, которые они защищают.
Рисунок \ (\ PageIndex {4} \): Использование жертвенного электрода для защиты от коррозии. Подключение магниевого стержня к подземному стальному трубопроводу защищает трубопровод от коррозии. Поскольку магний (E ° = −2.37 В) окисляется гораздо легче, чем железо (E ° = -0,45 В), стержень из магния действует как анод в гальваническом элементе. Таким образом, трубопровод вынужден действовать как катод, на котором восстанавливается кислород. Грунт между анодом и катодом действует как солевой мостик, замыкающий электрическую цепь и поддерживающий электрическую нейтральность. Когда Mg (s) окисляется до Mg 2 + на аноде, анионы в почве, такие как нитрат, диффундируют к аноду, чтобы нейтрализовать положительный заряд. Одновременно катионы в почве, такие как H + или NH 4 + , диффундируют по направлению к катоду, где они пополняют запас протонов, которые потребляются при восстановлении кислорода.\ circ _ {\ textrm {total}} = \ textrm {1,68 V}
\ end {align *} \]
Со временем железные винты растворятся, и лодка развалится.
- B Возможные способы предотвращения коррозии в порядке уменьшения стоимости и неудобств: разборка лодки и ее восстановление с помощью бронзовых винтов; вынуть лодку из воды и хранить в сухом месте; или прикрепление недорогого металлического цинка к карданному валу в качестве расходуемого электрода и его замену один или два раза в год.Поскольку цинк является более активным металлом, чем железо, он будет действовать как расходуемый анод в электрохимической ячейке и растворяться (уравнение \ (\ ref {Eq7} \)).
Цинковый расходный анод (закругленный объект, привинченный к нижней стороне корпуса), используемый для предотвращения коррозии винта в лодке за счет катодной защиты. Изображение Реми Каупп используется с разрешения.
Упражнение \ (\ PageIndex {1} \)
Предположим, водопроводные трубы, ведущие в ваш дом, сделаны из свинца, а остальная сантехника в вашем доме — из железа.Чтобы исключить возможность отравления свинцом, вы вызываете сантехника для замены свинцовых труб. Он называет вам очень низкую цену, если он сможет использовать имеющиеся у него запасы медных труб для выполнения этой работы.
- Вы принимаете его предложение?
- Чем еще должен заниматься сантехник у вас дома?
- Ответьте на
Нет, если вы не планируете продать дом очень скоро, потому что соединения труб \ (\ ce {Cu / Fe} \) приведут к быстрой коррозии.
- Ответ б
Любые существующие соединения \ (\ ce {Pb / Fe} \) должны быть тщательно осмотрены на предмет коррозии железных труб из-за соединения \ (\ ce {Pb – Fe} \); менее активный \ (\ ce {Pb} \) будет служить катодом для восстановления \ (\ ce {O2} \), способствуя окислению более активного \ (\ ce {Fe} \) поблизости.
Сводка
Коррозия — это гальванический процесс, который можно предотвратить с помощью катодной защиты.Разрушение металлов в результате окисления — это гальванический процесс, называемый коррозией. Защитные покрытия состоят из второго металла, который окисляется труднее, чем защищаемый металл. В качестве альтернативы, на металлическую поверхность можно нанести более легко окисляемый металл, тем самым обеспечивая катодную защиту поверхности. Тонкий слой цинка защищает оцинкованную сталь. Жертвенные электроды также могут быть прикреплены к объекту для его защиты.
Что такое коррозия?
Консервационная инфраструктура
Способность электрохимических процессов расщеплять соединения на элементы или создавать новые соединения может быть как разрушительной, так и продуктивной.Коррозия — это очень распространенный результат электрохимических реакций между материалами и веществами в окружающей их среде.
Коррозия — одно из самых разрушительных и дорогостоящих природных явлений, наблюдаемых сегодня.
Что такое коррозия?
Коррозия — опасная и очень дорогостоящая проблема. Из-за этого могут обрушиться здания и мосты, прорвутся нефтепроводы, протечка химических заводов и затопление ванных комнат. Корродированные электрические контакты могут вызвать возгорание и другие проблемы, корродированные медицинские имплантаты могут привести к заражению крови, а загрязнение воздуха вызвало коррозию произведений искусства по всему миру.Коррозия угрожает безопасному удалению радиоактивных отходов, которые должны храниться в контейнерах в течение десятков тысяч лет.
Наиболее распространенные виды коррозии возникают в результате электрохимических реакций. Общая коррозия возникает, когда большинство или все атомы на одной и той же металлической поверхности окисляются, повреждая всю поверхность. Большинство металлов легко окисляются: они склонны терять электроны из-за кислорода (и других веществ) в воздухе или в воде. Когда кислород восстанавливается (приобретает электроны), он образует оксид с металлом.
Процесс восстановления и окисления различных металлов, контактирующих друг с другом, называется гальванической коррозией. При электролитической коррозии, которая чаще всего встречается в электронном оборудовании, вода или другая влага попадает в ловушку между двумя электрическими контактами, между которыми прикладывается электрическое напряжение. Результат — непредусмотренная электролитическая ячейка.
Возьмите металлическую конструкцию, такую как Статуя Свободы. Выглядит прочно и прочно.Однако, как почти все металлические предметы, он может стать нестабильным, поскольку вступает в реакцию с веществами в окружающей среде и портится. Иногда эта коррозия безвредна или даже полезна: зеленоватая патина, покрывающая медную кожу статуи, защищает находящийся под ней металл от погодных повреждений. Однако внутри статуи коррозия за эти годы нанесла серьезный ущерб. Его железный каркас и медная обшивка действовали как электроды огромного гальванического элемента, так что почти половина каркаса заржавела к 1986 году, к столетнему юбилею статуи.
Естественная защита
Некоторые металлы приобретают естественную пассивность или устойчивость к коррозии. Это происходит, когда металл вступает в реакцию с кислородом воздуха или разъедает его. В результате образуется тонкая оксидная пленка, которая блокирует склонность металла к дальнейшей реакции. Примерами этого являются патина, образующаяся на меди, и выветривание некоторых скульптурных материалов. Защита не работает, если тонкая пленка повреждена или разрушена структурным напряжением — например, мостом — или царапинами или царапинами.В таких случаях материал может повторно пассивироваться, но если это невозможно, только части объекта подвергаются коррозии. Тогда ущерб часто еще больше, потому что он сосредоточен в этих местах.
Вредную коррозию можно предотвратить множеством способов. Электрические токи могут образовывать пассивные пленки на металлах, которые обычно не имеют их. Некоторые металлы более стабильны в определенных средах, чем другие, и ученые изобрели сплавы, такие как нержавеющая сталь, для улучшения характеристик в определенных условиях.Некоторые металлы можно обрабатывать лазером, чтобы придать им некристаллическую структуру, устойчивую к коррозии. При гальванике железо или сталь покрывают более активным цинком; это образует гальванический элемент, в котором коррозирует цинк, а не железо. Другие металлы защищены гальваническим покрытием инертным или пассивирующим металлом. Неметаллические покрытия — пластмассы, краски и масла — также могут предотвратить коррозию.
Corrosion Solution — подход Nanolab к борьбе с ржавчиной
Коррозия — это постепенное разрушение материала, обычно металлов, в результате химической реакции с окружающей средой.В наиболее распространенном использовании этого слова это означает электрохимическое окисление металлов в реакции с окислителем, таким как кислород. Ржавчина, образование оксидов железа, является хорошо известным примером электрохимической коррозии.
Повреждения этого типа обычно образуют оксид (ы) или соль (ы) исходного металла. Коррозия также может возникать в материалах, отличных от металлов, таких как керамика или полимеры, хотя в этом контексте чаще используется термин разрушение. Коррозия ухудшает полезные свойства материалов и конструкций, включая прочность, внешний вид и проницаемость для жидкостей и газов.
Коррозия металлов и сплавов приводит к окислению или селективному удалению материала с поверхности. Ремонт коррозии — это бизнес стоимостью в миллиард долларов, который затрагивает многие отрасли, такие как автомобилестроение, аэрокосмическая промышленность, биомедицинские устройства, краски и покрытия и полупроводники.
Инструменты для определения характеристик материалов и химического анализа поверхности используются для:
- Определить, есть ли коррозия на изделии
- Обнаружение незначительных примесей
- Измерьте толщину оксидных слоев
Методы первого выбора
Методы второго выбора
-> Формы запросов на обслуживание
-> Связаться с нами
Обработка поверхности для остановки коррозии
Оцинкованная поверхностьГальваника, окраска и нанесение эмали являются наиболее распространенными видами антикоррозийной обработки.Они работают, создавая барьер из коррозионно-стойкого материала между разрушающей средой и конструкционным материалом. Помимо косметических и производственных проблем, существует компромисс между механической гибкостью и устойчивостью к истиранию и высокой температуре. Покрытия обычно выходят из строя только на небольших участках, и если покрытие более благородное, чем подложка (например, хром на стали), гальваническая пара вызовет коррозию любой незащищенной области гораздо быстрее, чем поверхность без покрытия.По этой причине часто имеет смысл покрыть пластину активным металлом, таким как цинк или кадмий. Покраска валиком или кистью более предпочтительна для тесных пространств; спрей будет лучше для больших площадей покрытия, таких как стальные палубы и набережные. Гибкие полиуретановые покрытия, такие как, например, Durabak-M26, могут обеспечить антикоррозионное уплотнение с очень прочной устойчивой к скольжению мембраной. Окрашенные покрытия относительно легко наносить и они быстро сохнут, хотя температура и влажность могут привести к изменению времени высыхания.
Реактивные покрытия
Если окружающая среда находится под контролем (особенно в рециркуляционных системах), в нее часто можно добавлять ингибиторы коррозии. Они образуют электрически изолирующее или химически непроницаемое покрытие на открытых металлических поверхностях для подавления электрохимических реакций. Очевидно, что такие методы делают систему менее чувствительной к царапинам или дефектам покрытия, поскольку дополнительные ингибиторы могут быть доступны везде, где металл подвергается воздействию. К химическим веществам, замедляющим коррозию, относятся некоторые соли жесткой воды (римские водные системы известны своими минеральными отложениями), хроматы, фосфаты, полианилин, другие проводящие полимеры и широкий спектр специально разработанных химикатов, напоминающих поверхностно-активные вещества (т.е. длинноцепочечные органические молекулы с ионными концевыми группами).
Анодирование
Альпинистское спусковое устройство анодировано с желтым покрытиемАлюминиевые сплавы часто подвергаются поверхностной обработке. Электрохимические условия в ванне тщательно регулируются таким образом, чтобы в оксидной пленке металла появлялись однородные поры шириной несколько нанометров. Эти поры позволяют оксиду расти намного толще, чем позволяют условия пассивирования. В конце обработки поры закрываются, образуя более твердый, чем обычно, поверхностный слой.Если это покрытие поцарапано, для защиты поврежденного участка вступают в действие обычные процессы пассивации.
Анодирование очень устойчиво к атмосферным воздействиям и коррозии, поэтому его обычно используют для фасадов зданий и других участков, поверхность которых будет регулярно контактировать с элементами. Несмотря на то, что он эластичный, его необходимо часто чистить. Если оставить без очистки, края панели появятся естественным образом.
Биопленочные покрытия
Разработана новая форма защиты путем нанесения определенных видов бактериальных пленок на поверхность металлов в высококоррозионных средах.Этот процесс существенно увеличивает коррозионную стойкость. В качестве альтернативы можно использовать биопленки, продуцирующие противомикробные препараты, для подавления коррозии мягкой стали, вызванной сульфатредуцирующими бактериями.
Опалубка с контролируемой проницаемостью
Опалубка с контролируемой проницаемостью (CPF) — это метод предотвращения коррозии арматуры за счет естественного увеличения прочности покрытия во время укладки бетона. CPF использовался в окружающей среде для борьбы с воздействием углекислого газа, хлоридов, мороза и истирания.
Катодная защита
Катодная защита (CP) — это метод контроля коррозии металлической поверхности путем превращения этой поверхности в катод электрохимической ячейки. Системы катодной защиты чаще всего используются для защиты стальных, водяных и топливных трубопроводов и резервуаров; стальные сваи пирса, корабли и морские нефтяные платформы.
Жертвенный анод в корпусе корабля.Для эффективных КП потенциал стальной поверхности поляризуется (толкается) более отрицательно, пока металлическая поверхность не будет иметь однородный потенциал.При равномерном потенциале движущая сила реакции коррозии останавливается. В гальванических системах CP материал анода корродирует под воздействием стали, и в конечном итоге его необходимо заменить. Поляризация вызвана током, протекающим от анода к катоду, вызванным разностью электрохимических потенциалов между анодом и катодом.
Катодная защита наложенного тока
Для более крупных структур гальванические аноды не могут с экономической точки зрения обеспечивать ток, достаточный для обеспечения полной защиты.В системах катодной защиты наложенным током (ICCP) используются аноды, подключенные к источнику постоянного тока (например, выпрямителю катодной защиты). Аноды для систем ICCP представляют собой трубчатые и цельные стержневые формы из различных специализированных материалов. К ним относятся чугун с высоким содержанием кремния, графит, пруток и проволока с покрытием из смешанных оксидов металлов или платины, покрытые титаном или ниобием.
Анодная защита
Анодная защита подает анодный ток на защищаемую конструкцию (в противоположность катодной защите).Он подходит для металлов, которые проявляют пассивность (например, нержавеющая сталь) и достаточно малый пассивный ток в широком диапазоне потенциалов. Применяется в агрессивных средах, например, в растворах серной кислоты.
Коррозия | Безграничная химия
Коррозия
Коррозия возникает при разрушении металлов в результате химических процессов.
Цели обучения
Обсудить общие причины коррозии металлической поверхности
Основные выводы
Ключевые моменты
- Коррозия — это двухэтапный процесс, для которого требуются три вещи: металлическая поверхность, электролит и кислород.
- В процессе коррозии поверхностные атомы металла растворяются в водном растворе, оставляя металл с избыточным отрицательным зарядом. Образующиеся ионы удаляются подходящим акцептором электронов.
- Коррозия — это металлы, которые самопроизвольно возвращаются в форму своей руды в процессе окисления.
- Электропроводящие свойства металла позволяют окислению и восстановлению происходить на отдельных участках поверхности металла.
Ключевые термины
- коррозия : Химическая эрозия, особенно окисление.
Когда материалы портятся в результате химических процессов, они подвергаются коррозии. Коррозия обычно обсуждается применительно к металлам, которые корродируют электрохимически. Этот вид коррозии представляет собой двухэтапный процесс, для которого требуются три вещи: металлическая поверхность, электролит и кислород. В процессе коррозии атом металла на поверхности растворяется в водном растворе, оставляя металл с избыточными отрицательно заряженными ионами.Эти образующиеся ионы удаляются подходящим акцептором электронов. Коррозию можно рассматривать как самопроизвольное возвращение металлов в свои руды в процессе окисления.
Проводящие свойства металла позволяют этапам окисления и восстановления, которые происходят во время коррозии, происходить на отдельных участках поверхности металла. Проводимость позволяет электронам течь из анодной в катодную области металла.
В системе коррозии подверженный коррозии металл действует как анод короткозамкнутой электрохимической ячейки:
[латекс] \ text {Fe} (\ text {s}) \ rightarrow \ text {Fe} ^ {2+} (\ text {aq}) + 2 \ text {e} ^ — [/ latex]
Коррозия — это неприятность : На этой фотографии железного моста через реку Нанду на Хайнане, Китай, показаны доказательства повреждений, вызванных коррозией.- \ rightarrow \ text {M} (\ text {s}) [/ latex]
На этой катодной ступени M — металл.
Насколько подвержен коррозии тот или иной металл, можно определить по его восстановительному потенциалу. Чем выше восстановительный потенциал металла, тем меньше вероятность его окисления.
Коррозия — обычная неприятность с реальными ударами. Мы видим его последствия в ржавых каркасах автомобилей, прорыве водопровода и разрушении мостов.
Предотвращение коррозии
Предотвращение коррозии снижает как экономический, так и связанный с безопасностью ущерб, связанный с технологическим процессом.
Цели обучения
Обсудите общие профилактические меры, которые можно предпринять против коррозии металлической поверхности
Основные выводы
Ключевые моменты
- Для возникновения коррозии необходимы три фактора: электролит, открытая металлическая поверхность и акцептор электронов.
- Коррозию можно предотвратить, сняв одно из этих условий.
- Покрытие металлической поверхности краской или эмалью создает барьер между металлом и влагой окружающей среды.
- Процесс покрытия металлической поверхности другим металлом, который с большей вероятностью окисляется, называется жертвенным покрытием.
Ключевые термины
- электролит : Вещество, которое в растворе или в расплавленном состоянии ионизирует и проводит электричество.
- жертвенное покрытие : Металлическое покрытие, которое подвержено окислению с большей вероятностью, чем металл, который оно защищает.
- гальваника : для электрохимического покрытия тонким слоем металла; к гальванике.
Проверка коррозии
Мы узнали, что для анодной и катодной стадий коррозии необходимы три вещи: электролит, открытая металлическая поверхность и акцептор электронов. Отсюда следует, что мы можем предотвратить коррозию, удалив одно из этих важных условий. Самое простое условие для удаления — это оголенная металлическая поверхность.
Создание физического барьера
Покрытие металлической поверхности краской или эмалью создает барьер между металлом и влагой в окружающей среде, тем самым устраняя возможность контакта кислорода и влаги с металлом.
Жертвенные покрытия
Процесс покрытия металлической поверхности другим металлом, который с большей вероятностью окисляется, называется жертвенным покрытием. Сталь из сплава железа, подверженная коррозии, обычно покрывается цинком, более активным металлом, в процессе, известном как цинкование. Коррозия жертвенного цинка приводит к его окислению; железо восстанавливается, что делает его катодным и препятствует его коррозии.
Оцинкованная поверхность : Защита сплавов железа покрытием из более активного металла посредством процесса цинкования предотвращает коррозию сплавов.
Контраст с предыдущим сценарием можно увидеть, когда железо или железный сплав покрывают менее активным металлом, например оловом. Пока оловянное покрытие остается неповрежденным, коррозия невозможна. Однако, если оловянное покрытие ухудшится, обнажая лежащий под ним металл, произойдет коррозия. Это связано с тем, что обнаженное железо подвергается окислению и становится анодным. Олово принимает электроны от окисленного железа, и соблюдаются три критерия коррозии.
Катодная защита
Еще один способ защиты от коррозии — создание постоянного отрицательного электрического заряда на металле.Этот метод называется катодной защитой. Катодная защита воспроизводит эффект жертвенного покрытия, но с более активным металлом. Источником отрицательного заряда обычно является внешний источник постоянного тока. Катодная защита используется, в частности, для защиты подземных топливных баков и трубопроводов.
Пассивация
Пассивация — это процесс, при котором на металлической поверхности образуется тонкая пленка продуктов коррозии, служащая барьером против окисления.На формирование пассивирующего слоя влияют pH окружающей среды, температура и химические условия. Статуя Свободы, например, покрыта сине-зеленой патиной, вызванной несколькими химическими реакциями, которая защищает металлическую медь под ней.
Анодирование
Анодирование — это еще одна обработка поверхности, защищающая от коррозии. Защищаемый металл покрывается специальным веществом, а электрохимические условия регулируются таким образом, чтобы в оксидной пленке металла появлялись однородные поры шириной несколько нанометров.Эти поры позволяют образовываться оксидной пленке, более толстой, чем пассивирующий слой. Полученный защитный слой очень твердый и очень эластичный.
Жертвенная защита анода
По тому же принципу, что и временное пленочное покрытие, расходуемый анод, сделанный из металла, более активного, чем металл, который вы хотите защитить, можно использовать для предотвращения коррозии металлических конструкций, погруженных в воду или заглубленных в землю. Жертвенный анод подвергнется коррозии раньше, чем металл, который он защищает. Однако, как только расходуемый анод подвергнется коррозии, его необходимо заменить; в противном случае металл, который она защищает, тоже начнет разъедать.
Катодная защита предотвращает коррозию : Гальванический расходный анод, прикрепленный к корпусу корабля; Здесь протекторный анод показывает коррозию, а металл, к которому он прикреплен, — нет. Анод, кусок более электрохимически «активного» металла, прикреплен к уязвимой поверхности металла, где он подвергается воздействию электролита; потенциал уязвимой поверхности поляризован, чтобы быть более отрицательным, пока поверхность не будет иметь однородный потенциал. На этом этапе устраняется движущая сила реакции коррозии с защищаемой поверхностью.Гальванический анод продолжает корродировать, расходуя материал анода, пока в конечном итоге его не нужно будет заменить, но катодный материал защищен.
Коррозия представляет реальную угрозу целостности личного имущества, а также мостов, дорог и другой общественной инфраструктуры. Понимание и реализация стратегий предотвращения коррозии уменьшит как экономический ущерб, так и ущерб, связанный с безопасностью, связанный с процессом.
Коррозия металлов
Теория коррозии металлов
Коррозия определяется как повреждение материала в результате
химическая, часто электрохимическая реакция с окружающей средой.Согласно этому определению термин «коррозия» может применяться ко всем
материалы, в том числе неметаллы. Но на практике слово коррозия в основном используется в
в сочетании с металлическими материалами.
Почему металлы корродируют? Помимо золота, платины и некоторых других,
в чистом виде металлы в природе не встречаются. Они обычно
химически связаны с другими веществами в рудах, такими как сульфиды, оксиды и т. д.Энергия должна быть затрачена (например, в доменной печи) для извлечения металлов из
сульфиды, оксиды и т. д. для получения чистых металлов.
Чистые металлы содержат больше связанной энергии, представляя собой
более высокое энергетическое состояние, чем в природе в виде сульфидов или оксидов.
Энергетическое состояние металла в различных формах
Поскольку весь материал во Вселенной стремится вернуться к своему низкому уровню
энергетическое состояние, чистые металлы также стремятся вернуться к своему самому низкому энергетическому состоянию
которые у них были в виде сульфидов или оксидов.Один из способов, которыми металлы могут
возврат к низкому уровню энергии происходит за счет коррозии. Продукты коррозии
металлы часто представляют собой сульфиды или оксиды.
Химическая и электрохимическая коррозия
Химическая коррозия может рассматриваться как окисление и происходит под действием
сухих газов, часто при высоких температурах. С другой стороны, имеет место электрохимическая коррозия.
электродными реакциями, часто во влажной среде, т.е.е. влажная коррозия.
Все металлы в сухом воздухе покрыты очень тонким слоем оксида,
мощностью около 100 (10 -2 м). Этот слой образован химическими веществами.
коррозия кислородом воздуха. При очень высоких температурах реакция
с кислородом в воздухе может продолжаться без ограничений, и металл быстро превратится в
оксид.
Окисление металла при разных температурах
При комнатной температуре реакция останавливается, когда слой становится тонким.Эти
тонкие слои оксида могут защитить металл от продолжительного воздействия, например в
водный раствор. На самом деле именно эти слои оксида
и / или продукты коррозии, образующиеся на поверхности металла, защищающие
металл от продолжающегося воздействия в гораздо большей степени, чем коррозия
сопротивление самого металла.
Эти слои оксида могут быть более или менее прочными в
вода, например.Мы знаем, что обычная углеродистая сталь быстрее корродирует в воде.
чем нержавеющая сталь. Разница зависит от состава и
проницаемость их соответственно оксидных слоев. Следующее описание
явление коррозии касается только электрохимической коррозии, т.е.
влажная коррозия.
Ячейки коррозии
Как металлы корродируют в жидкостях? Проиллюстрируем это,
используя явление коррозии, называемое биметаллической коррозией или гальванической коррозией.Биметаллическая коррозионная ячейка может, например, состоят из стальной пластины и медной пластины
в электрическом контакте друг с другом и погружены в водный раствор
(электролит).
Электролит содержит растворенный кислород из воздуха.
и растворенная соль. Если лампа подключена между стальной пластиной и
медная пластина, она загорится. Это указывает на то, что ток течет между
металлические пластины.Медь будет положительным электродом, а сталь —
быть отрицательным электродом.
Ток течет через лампу от медной пластины к стальной пластине
Движущей силой тока является разница в электрическом
потенциал между медью и сталью. Цепь должна быть замкнута и
следовательно, ток будет течь в жидкости (электролите) от стального листа.
к медной пластине.Ток протекает через положительно заряженный
атомы железа (ионы железа) покидают стальную пластину, и стальная пластина подвергается коррозии.
Корродирующая металлическая поверхность называется анодом. Кислород
и вода расходуются на поверхности медной пластины, а гидроксильные ионы
(ОН-), которые имеют отрицательный заряд, образуются. Отрицательные ионы гидроксила
«нейтрализовать» положительно заряженные атомы железа.Ионы железа и гидроксила образуют
гидроксид железа (ржавчина).
В описанной выше коррозионной ячейке металлическая медь
называется катодом. Обе металлические пластины называются электродами, а
определение анода и катода дано ниже.
Анод : Электрод, от которого течет положительный ток.
в электролит.
Катод : Электрод, через который проходит положительный электрический ток.
ток уходит из электролита.
Когда положительные атомы железа переходят в раствор из стальной пластины,
электроны остаются в металле и переносятся в обратном направлении, в сторону
положительный ток.
Предпосылки для
К формированию биметаллической ячейки относятся:
1.Электролит
2. Анод
3. Катод
4. Окислительная среда, например растворенный кислород (O 2 ) или ионы водорода.
(H + ).
Электродный потенциал — гальваническая серия
В приведенном выше примере
было показано, что движущая сила для протекания тока и, следовательно,
Коррозия — это разность электродных потенциалов.Электродный потенциал
металл — это показатель склонности металла к растворению и коррозии.
в определенном электролите.
Также упоминается «благородство» металла. Более благородный
металла, чем выше потенциал, тем меньше у него тенденция к
раствориться в электролите.
Электродные потенциалы различных металлов могут быть указаны в
отношение друг к другу в гальваническом ряду для разных электролитов.В
гальванический ряд различных металлов в морской воде показан ниже.
Золото | +0,42 |
| Серебро | +0,19 |
Нержавеющая сталь (AISI 304), пассивное состояние | +0.09 |
| Медь | +0,02 |
| Олово | -0,26 |
Нержавеющая сталь (AISI 304), активное состояние | -0,29 |
| Свинец | -0,31 |
| Сталь | -0.46 |
| Кадмий | -0,49 |
| Алюминий | -0,51 |
| Оцинкованная сталь | -0,81 |
| цинк | -0,86 |
| Магний | -1,36 |
Учитывая сталь-медь
Например, из приведенной выше таблицы будет отмечено, что медь имеет более высокий потенциал (
благороднее), чем обычная углеродистая сталь.Сталь будет анодом и корродирует,
тогда как медь будет катодом и не подвергнется коррозии.
Коррозия в микроячейках
Сталь-медь
пример показал, как происходит коррозия, когда два разных материала
соединен в водном растворе. Как происходит коррозия на поверхности
из цельного металла? Когда поверхность металла исследуется под микроскопом,
будет видно, что это не один однородный металл.Различия в
структура и размер зерна возникают на поверхности. Химический состав может
варьируются, и могут присутствовать различные примеси.
Если потенциал электрода измеряется на очевидном
однородной поверхности, будет обнаружено, что она значительно варьируется в пределах только
доли квадратного миллиметра. Итак, катоды и аноды, возможно, маленькие, но
достаточно большой, чтобы вызвать коррозию, может быть сформирован на той же металлической поверхности.В результате анодной и катодной реакций образовалась коррозионная микроячейка.
описано ниже.
Анодная часть поверхности корродирована
В случае низкого pH катодная реакция будет: 2e — +
2H + → H 2 . Поверхность катода может быть
примеси, такие как оксидные включения, усиление графита или более благородная фаза.
Коррозия — Химия: Первые атомы 2e
Цели обучения
К концу этого раздела вы сможете:
- Определить коррозию
- Перечислите некоторые методы, используемые для предотвращения или замедления коррозии
Коррозия обычно определяется как разложение металлов в результате естественного электрохимического процесса. Образование ржавчины на железе, потускнение серебра и сине-зеленая патина на меди — все это примеры коррозии.Общие затраты на устранение коррозии в Соединенных Штатах значительны и оцениваются более чем в полтриллиона долларов в год.
Статуя Свободы: меняя цвета Статуя Свободы — достопримечательность, которую признает каждый американец. Статую Свободы легко узнать по ее высоте, положению и уникальному сине-зеленому цвету ((Рисунок)). Когда эта статуя впервые была доставлена из Франции, она не имела зеленого цвета. Оно было коричневым, цвета его медной «кожи». Так как же Статуя Свободы изменила цвет? Изменение внешнего вида было прямым результатом коррозии.Медь, которая является основным компонентом статуи, медленно подвергалась окислению на воздухе. Окислительно-восстановительные реакции металлической меди в окружающей среде протекают в несколько стадий. Металлическая медь окисляется до оксида меди (I) (Cu 2 O), который имеет красный цвет, а затем до оксида меди (II), который имеет черный цвет
.
Уголь, часто содержащий большое количество серы, активно сжигался в начале прошлого века. В результате атмосферный триоксид серы, диоксид углерода и вода прореагировали с CuO
.
Эти три соединения ответственны за характерную сине-зеленую патину на Статуе Свободы (и других медных конструкциях на открытом воздухе).К счастью, образование патины создает защитный слой на поверхности меди, предотвращая дальнейшую коррозию находящейся под ней меди. Формирование защитного слоя называется пассивацией , явление, которое обсуждается далее в другой главе этого текста.
(a) Статуя Свободы покрыта медной кожей и изначально была коричневой, как показано на этой картине. (б) Воздействие элементов привело к образованию сине-зеленой патины, наблюдаемой сегодня.
Пожалуй, самый известный пример коррозии — это образование ржавчины на железе.Железо ржавеет под воздействием кислорода и воды. Образование ржавчины включает создание гальванического элемента на поверхности железа, как показано на (Рисунок). Соответствующие окислительно-восстановительные реакции описываются следующими уравнениями:
Дальнейшая реакция продукта железа (II) во влажном воздухе приводит к образованию гидрата оксида железа (III), известного как ржавчина:
Стехиометрия гидрата варьируется, на что указывает использование x в формуле соединения. В отличие от патины на меди, образование ржавчины не создает защитного слоя, поэтому коррозия железа продолжается, поскольку ржавчина отслаивается и подвергает свежее железо воздействию атмосферы.
Коррозия может возникнуть, когда окрашенная железная или стальная поверхность подвергается воздействию окружающей среды в результате царапины на краске. Результаты гальванического элемента, которые могут быть аппроксимированы упрощенной схемой элемента Fe ( s ) | Fe 2+ ( водн. ) || O 2 ( водн. ), H 2 O ( л ) | Fe ( с ).
Один из способов уберечь железо от коррозии — это держать его в краске. Слой краски предотвращает попадание воды и кислорода, необходимых для образования ржавчины, на утюг.Пока краска остается неповрежденной, утюг защищен от коррозии.
Другие стратегии включают легирование железа другими металлами. Например, нержавеющая сталь — это сплав железа, содержащий небольшое количество хрома. Хром имеет тенденцию собираться у поверхности, где он корродирует и образует пассивирующий оксидный слой, защищающий железо.
Железо и другие металлы также могут быть защищены от коррозии с помощью гальванизации — процесса, при котором защищаемый металл покрывается слоем более легко окисляемого металла, обычно цинка.Когда слой цинка не поврежден, он предотвращает контакт воздуха с лежащим под ним железом и, таким образом, предотвращает коррозию. Если слой цинка поврежден в результате коррозии или механического истирания, железо все еще может быть защищено от коррозии с помощью процесса катодной защиты , который описан в следующем параграфе.
Еще один важный способ защиты металла — это сделать его катодом в гальваническом элементе. Это катодная защита, которую можно использовать не только для железа, но и для других металлов. Например, ржавление подземных резервуаров для хранения железа и труб можно предотвратить или значительно уменьшить, подключив их к более активному металлу, такому как цинк или магний ((Рисунок)).Это также используется для защиты металлических частей водонагревателей. Более активные металлы (более низкий потенциал восстановления) называются расходуемыми анодами, потому что по мере их использования они коррозируют (окисляются) на аноде. Защищаемый металл служит катодом для восстановления кислорода в воздухе, и поэтому он просто служит для проведения (а не реакции) переносимых электронов. Когда аноды подвергаются надлежащему контролю и периодически заменяются, полезный срок службы резервуара для хранения железа может быть значительно увеличен.
Катодная защита — полезный подход к электрохимическому предотвращению коррозии подземных резервуаров.
Основные понятия и краткое изложение
Самопроизвольное окисление металлов естественными электрохимическими процессами называется коррозией, известные примеры включают ржавление железа и потускнение серебра. Процесс коррозии включает создание гальванического элемента, в котором различные участки металлического объекта функционируют как анод и катод, а коррозия происходит на анодном участке.Подходы к предотвращению коррозии металлов включают использование защитного покрытия из цинка (гальваника) и использование расходуемых анодов, соединенных с металлическим объектом (катодная защита).
Химия: упражнения в конце главы
Какой элемент каждой пары металлов с большей вероятностью подвержен коррозии (окислению)?
(а) Mg или Ca
(б) Au или Hg
(c) Fe или Zn
(d) Ag или Pt
Рассмотрим следующие металлы: Ag, Au, Mg, Ni и Zn.Какой из этих металлов можно использовать в качестве расходуемого анода в катодной защите подземного стального резервуара для хранения? Сталь — это сплав, состоящий в основном из железа, поэтому используйте -0,447 В в качестве стандартного потенциала восстановления для стали.
Алюминий окисляется легче, чем железо, и все же, когда оба они подвергаются воздействию окружающей среды, необработанный алюминий имеет очень хорошую коррозионную стойкость, в то время как коррозионная стойкость необработанного железа оставляет желать лучшего. Чем можно объяснить это наблюдение?
Если образец железа и образец цинка соприкасаются, цинк разъедает, а железо — нет.Если образец железа соприкасается с образцом меди, железо разъедает, а медь — нет. Объясните этот феномен.
Оба примера включают катодную защиту. (Жертвенный) анод — это металл, который коррозирует (окисляется или вступает в реакцию). В случае железа (-0,447 В) и цинка (-0,7618 В) цинк имеет более отрицательный стандартный восстановительный потенциал и поэтому служит анодом. В случае железа и меди (0,34 В) железо имеет меньший стандартный восстановительный потенциал и поэтому подвергается коррозии (служит анодом).
Предположим, у вас есть три разных металла: A, B и C. Когда металлы A и B соприкасаются, B корродирует, а A не корродирует. Когда металлы A и C соприкасаются, A корродирует, а C не корродирует. Основываясь на этой информации, какой металл подвергается коррозии, а какой не подвергается коррозии при контакте B и C?
Почему жертвенный анод из металлического лития — плохой выбор
Хотя восстановительный потенциал лития делает его способным защищать другие металлы, этот высокий потенциал также указывает на то, насколько литий реакционноспособен; он будет иметь спонтанную реакцию с большинством веществ.Это означает, что литий будет быстро реагировать с другими веществами, даже с теми, которые не окисляют металл, который он пытается защитить. Такая реактивность означает, что расходуемый анод будет быстро истощаться и его нужно будет часто заменять. (Необязательная дополнительная причина: опасность возгорания в присутствии воды.)
Глоссарий
- катодная защита
- к предотвращению коррозии металлического объекта путем подключения его к расходуемому аноду , состоящему из более легко окисляемого металла
Подход
- коррозия
- разложение металла в результате естественного электрохимического процесса
- оцинковка
- способ защиты железа или подобных металлов от коррозии путем покрытия тонким слоем более легко окисляемого цинка.
- расходуемый анод
- электрод, изготовленный из легко окисляемого металла, часто магния или цинка, используемый для предотвращения коррозии металлических предметов за счет катодной защиты
- солевой мостик
- трубка с инертным раствором электролита
.
 Такой
Такой